题目内容
9.有10.2克镁铝合金恰好溶于250mL 4mol•L-1的盐酸中,现加入2mol•L-1的氢氧化钠溶液.请回答:(1)要使产生的沉淀的质量最大,需加入的氢氧化钠溶液的体积是500mL
(2)要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积是600mL.
分析 (1)酸碱恰好中和时生成沉淀的质量最大;
(3)根据金属恰好溶于盐酸,利用金属的物质的量和生成的氯化镁和氯化铝中氯离子的关系来列式计算出镁和铝物质的量,再根据氢氧化镁不与碱反应,但氢氧化铝能与碱反应来计算要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积.
解答 解:(1)因酸碱恰好中和时生成沉淀的质量最大,
设加入的氢氧化钠溶液的体积为V,
则:0.25L×4mol•L-1=V×2mol•L-1,
解得:V=0.5L=500mL,
故答案为:500;
(2)设镁的物质的量为x,铝的物质的量为y,根据Mg+2HCl═MgCl2+H2↑、2Al+6HCl═2AlCl3+3H2↑可知,
24x+27y=10.2g、2x+3y=4mol/L×0.25L,
解得:x=0.2mol、y=0.2mol,
若沉淀只有氢氧化镁,则在沉淀达到最多后发生反应:Al(OH)3+OH-═AlO2-+H2O,
设该反应消耗的碱的体积为z,则
Al~Al(OH)3~OH-,
1 1
0.2mol z×2mol•L-1
解得:z=0.1L=100mL,
则要使产生的沉淀只有氢氧化镁,至少需加入的氢氧化钠溶液的体积为:500mL+100mL=600mL,
故答案为:600.
点评 本题考查混合物反应的计算,题目难度中等,明确酸碱恰好中和时沉淀质量最大及氢氧化铝能溶于强碱时解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
19.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| D. | 1mol金刚石含4NAC-C键 |
20.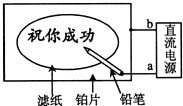 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生还原反应 | B. | 铂片端作阳极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
17.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=12溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
14.下列说法正确的是( )
| A. | 原子半径大小:Na>P>N | B. | 金属性强弱:K>Na>Ca | ||
| C. | 酸性强弱:H2SiO3>H2CO3 | D. | 碱性强弱:LiOH>NaOH>KOH? |
1.含硅元素的物质有很多用途,下列说法不正确的是( )
| A. | 水玻璃是硅酸钠的水溶液,可用作木材防火剂的原料 | |
| B. | 化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是SiO2 | |
| C. | 我国的三峡大坝使用了大量水泥,水泥是硅酸盐材料 | |
| D. | 光导纤维主要成份为SiO2,可用作太阳能电池 |
19.天平的两个托盘上均放有盛200mL 0.5mol•L-1的H2SO4溶液的烧杯,天平平衡,向两烧杯中分别加入Na和Mg单质,反应完成后天平仍保持平衡,则加入的两金属可能组合是( )
| A. | 各加入2.3g | B. | 各加入0.1mol | C. | 各加入0.01mol | D. | 各加入0.23g |

 ;
; ;
; (填结构简式).
(填结构简式).