题目内容
3.现对0.1mol/L的纯碱溶液进行相关研究.(1)用pH试纸测定该溶液的pH,其正确的操作把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH.
(2)纯碱溶液呈碱性的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%.请你设计实验证明该同学的观点是否正确.用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%.
(4)某同学根据所学知识对Na2CO3溶液进行分析,写出了以下四个关系式.请你判断:在正确的关系式后面打“√”,在错误的后面写出正确的关系式.
①c(Na+)=2[c(CO32-)+c(HCO3-)]:错误;c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
②c(Na+)+c(H+)=2 c(CO32-)+c(HCO3-)+c(OH-):√;
③c(OH-)=c(H+)+c(HCO3-)+c(H2CO3):错误;c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);
④c(Na+)>c(CO32-)>c(OH-)>c(HCO3-):√.
分析 (1)pH试纸的正确使用方法是:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH;
(2)根据盐的类型分析呈碱性,纯碱是强碱弱酸盐水解呈碱性;
(3)用pH试纸测pH值计算水解产生的氢氧根离子的浓度;
(4)根据电荷守恒、物料守恒和质子守恒分析.
解答 解:(1)测定溶液pH的具体操作方法为:用干净的玻璃棒蘸取待测溶液并滴在pH试纸上,把试纸显示的颜色与标准比色卡对照,读出相同颜色的pH值,
故答案为:把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH;
(2)纯碱是强碱弱酸盐,碳酸根离子能发生水解使溶液中的氢氧根离子的浓度大于氢离子的浓度,导致溶液呈碱性,离子方程式为 CO32-+H2O?HCO3-+OH-,故答案为; CO32-+H2O?HCO3-+OH-;
(3)用pH试纸测pH值计算水解产生的氢氧根离子的浓度,其操作为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%,故答案为:用pH试纸测0.1mol/L的Na2CO3溶液的pH,若pH<12,则证明水解的CO32-不超过其总量的10%;
(4)①根据物料守恒,碳元素在溶液中的形式有:CO32-、HCO3-、H2CO3、所以c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故答案为:错误;c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
②根据电荷守恒分析解答,c(Na+)+c(H+)=2 c(CO32-)+c(HCO3-)+c(OH-),故答案为:√;
③根据质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故答案为:错误;c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3);
④碳酸钠溶液水解呈碱性,所以离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故答案为:√.
点评 本题考查了盐类水解的原理,溶液酸碱性的实验测定方法,溶液中的守恒关系的应用,题目难度中等.

| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+═CO2↑+H2O | |
| C. | 实验室用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ |
| 混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
| (1)MgO中混有少量Al2O3杂质 | NaOH | Al2O3+2OH-=2AlO2-+H2O |
| (2)FeCl2溶液中混少量FeCl3 | Fe | 2Fe3++Fe=3Fe2+ |
| (3)FeCl3溶液中混少量FeCl2 | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| (4)FeSO4溶液中混少量CuSO4 | Fe | Fe+Cu2+=Cu+Fe2+ |
| (5)NaHCO3溶液中混有少量Na2CO3 | CO2 | CO32-+H2O+CO2=2HCO3- |
| (6)Mg溶液中混有少量Si杂质 | NaOH | 2Si+2OH-+H2O=SiO32-+2H2↑ |
| (7)CO2中混有少量HCl杂质 | NaHCO3 | HCO3-+H+=CO2↑+H2O |
| (8)NaCl溶液中混有少量NaBr | Cl2 | Cl2+2Br-=2Cl-+Br2 |
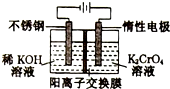
| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
| A. | 取用NaOH待测液前用少量水洗涤锥形瓶 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 摇动锥形瓶时有少量待测液溅出瓶外 | |
| D. | 滴定前滴定管中有气泡,滴定后消失 |
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α>1×10-14(填“>”“<”或“=”),作出此判断的理由是
升高温度,水的电离程度增大,离子积增大.
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关系正确的是AC
A.c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
| A. | Ⅰ中溶液不分层,溶液由棕黄色变成浅绿色 | |
| B. | Ⅱ中溶液分层,下层呈紫红色 | |
| C. | Ⅲ中溶液分层,下层呈紫红色 | |
| D. | Ⅳ中溶液分层,下层呈紫红色 |
(1)铁是人体必需的微量元素,下列物质中加入了铁强化剂的是②(填序号).
①食盐 ②酱油
(2)现有4种食物:①鸡蛋、②,牛肉、③白菜、④胡萝卜.其中,属于碱性食物的是③
④(填序号).
(3)全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在不同条件下铁锈蚀的快慢,设计了如下实验.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 |  | 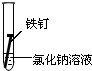 |  |
②实验Ⅱ中发生的是电化学腐蚀(填“电化学腐蚀”或“化学腐蚀”).
③下列防止钢铁锈蚀的措施合理的是ac(填字母).
a.自行车的钢圈表面镀镍
b.地下钢铁管道上连接铜块
c.健身器材刷油漆
(4)抗酸药物的作用是中和胃里过多的胃酸.某抗酸药的主要成分是碳酸氢钠,写出碳酸氢钠与盐酸反应的离子方程式:HCO3-+H+=C02↑+H2O.若此抗酸药每片含碳酸氢钠0.42g,取此药一片研碎后与足量的盐酸反应,生成气体在标准状况下的体积为0.12L.
 、
、 .
.