题目内容
10.下列说法不正确的是( )| A. | 同种元素的质子数必定相同 | |
| B. | 元素的化学性质主要决定于原子的最外层电子数 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | 元素性质呈现周期性变化的根本原因是核外电子排布呈周期性变化 |
分析 A.根据元素的定义判断;
B.原子核外的最外层电子数决定元素的性质;
C.氕原子不含中子;
D.原子核外的最外层电子数决定元素的性质,因核外电子排布呈周期性变化,则元素性质呈现周期性变化.
解答 解:A.元素是具有相同质子数的一类原子的总称,因此同种元素的质子数必定相同,故A正确;
B.元素的性质,特别是化学性质,与原子的最外层电子数关系非常密切,原子的最外层电子少于4个时,容易失去电子;多于4个少于8个时,容易获得电子.最外层为8个电子时,元素的化学性质最稳定,故B正确;
C.氕原子不含中子,仅含有1个质子,故C错误;
D.原子核外的最外层电子数决定元素的性质,因核外电子排布呈周期性变化,则元素性质呈现周期性变化,故D正确.
故选C.
点评 本题综合考查原子的结构与元素的性质,为高频考点和常见题型,侧重于双基的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
20.发展低成本、新型太阳能是解决未来社会能源问题的有效途径.目前,太阳能电池的发展已经进入了第三代,其常用材料除单晶硅,还有铜铟镓硒等化物质.完成下列填空:
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1或1s22s22p63s23p63d54s1.
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示)Br>As>Se.
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子之间还形成了π键.
(4)金属铜能形成多种配合物,如复合物氯化羰基亚铜[Cu2C12(CO)2•2H2O],其结构如图1.
①该配合物中Cl原子的杂化类型为sp3.
②该配合物中的配位体有3种.
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
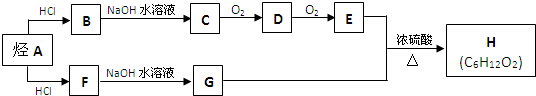
(6)单晶硅的结构与金刚石结构相似(如图2),若将金刚石晶体中一半的C原子换成Si原子,则得如图2所示的金刚砂(SiC)结构.在SiC中,每个C原子周围最近的C原子数目为12;若SiC晶体密度为ag.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$ cm (列式表示).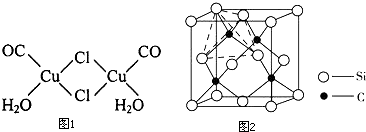
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1或1s22s22p63s23p63d54s1.
(2)硒为第四周期元素,相邻的元素有砷和溴,则这3种元素的第一电离能从大到小顺序(用元素符号表示)Br>As>Se.
(3)硼元素与镓元素处于同一主族,三氟化硼分子的空间构型是平面三角形;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如表.硼卤键长实测值比计算值要短得多,可能的原因是B与X原子之间还形成了π键.
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
①该配合物中Cl原子的杂化类型为sp3.
②该配合物中的配位体有3种.
(5)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(6)单晶硅的结构与金刚石结构相似(如图2),若将金刚石晶体中一半的C原子换成Si原子,则得如图2所示的金刚砂(SiC)结构.在SiC中,每个C原子周围最近的C原子数目为12;若SiC晶体密度为ag.cm-3,SiC的摩尔质量为M g.mol-1,阿伏伽德罗常数用NA表示,则Si与C最近的距离为$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{a{N}_{A}}}$ cm (列式表示).

1.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| D. | 将水加热,KW增大,pH不变 |
18.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,导致测得NaOH溶液浓度偏高的是( )
| A. | 取用NaOH待测液前用少量水洗涤锥形瓶 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 摇动锥形瓶时有少量待测液溅出瓶外 | |
| D. | 滴定前滴定管中有气泡,滴定后消失 |
15.取碘水四份分别置于编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ的试管中,再分别加入HCl溶液、酒精、汽油、CCl4,振荡后静置,下列现象描述正确的是( )
| A. | Ⅰ中溶液不分层,溶液由棕黄色变成浅绿色 | |
| B. | Ⅱ中溶液分层,下层呈紫红色 | |
| C. | Ⅲ中溶液分层,下层呈紫红色 | |
| D. | Ⅳ中溶液分层,下层呈紫红色 |
2.X、Y、Z、W四种元素在周期表中相对位置如表所示,已知:Y、Z质子数之和为21,下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | X、Y、Z、W四种元素均为非金属元素 | |
| B. | Y、W的最简单氢化物中,Y的沸点高 | |
| C. | X、Y、Z、W最高价氧化物均为共价化合物 | |
| D. | W元素的简单离子半径小于Z元素的简单离子半径 |
19.可用来鉴别乙醇、乙醛、乙酸溶液的试剂是( )
| A. | 新制氢氧化铜悬浊液 | B. | 酸性高锰酸钾溶液 | ||
| C. | 银氨溶液 | D. | 碳酸钠溶液 |
 CH3CH2COOCH(CH3)2+H2O.
CH3CH2COOCH(CH3)2+H2O. .(用结构简式表示)
.(用结构简式表示)