14.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1的NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )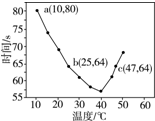

| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
13.燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池.下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )
| A. | 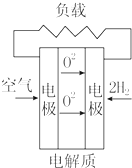 固体氧化物燃料电池 | B. | 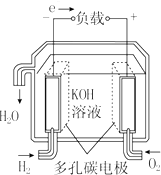 碱性燃料电池 | ||
| C. | 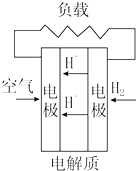 质子交换膜燃料电池 | D. | 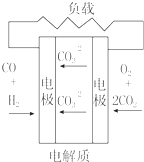 熔融盐燃料电池 |
11.下列关于有机物的叙述不正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 分子式为C3H7Cl的同分异构体共有2种 | |
| D. | 谷氨酸分子(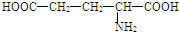 )间缩合可形成二肽 )间缩合可形成二肽 |
10.下列说法正确的是( )
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
8.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子变换法回收钒的新工艺,回收率达到91.7%.
部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如图所示:
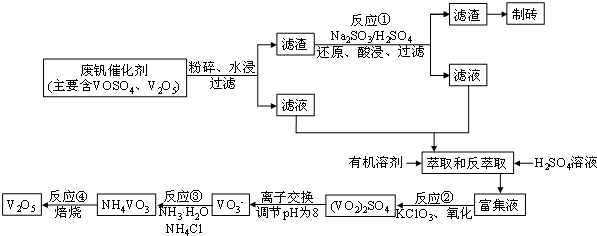
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
7.下列实验操作和对应的现象、结论都正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
6.现有三种元素基态原子的电子排布式:①1s22s23p2②1s22s23p3 ③1s22s23p4下列有关比较中正确的是( )
0 169865 169873 169879 169883 169889 169891 169895 169901 169903 169909 169915 169919 169921 169925 169931 169933 169939 169943 169945 169949 169951 169955 169957 169959 169960 169961 169963 169964 169965 169967 169969 169973 169975 169979 169981 169985 169991 169993 169999 170003 170005 170009 170015 170021 170023 170029 170033 170035 170041 170045 170051 170059 203614
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
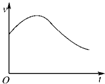 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.