题目内容
13.燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池.下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是( )| A. | 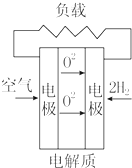 固体氧化物燃料电池 | B. | 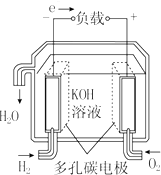 碱性燃料电池 | ||
| C. | 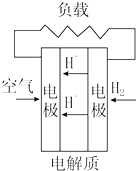 质子交换膜燃料电池 | D. | 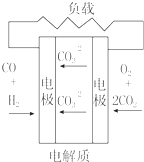 熔融盐燃料电池 |
分析 在氢氧燃料电池中,正极是氧气发生还原反应,当电解质溶液是氢氧化钾时,正极上氧气得电子生成氢氧根离子;当电解质溶液是酸时,正极上氧气和氢离子反应生成水;当电解质为能够传导氧离子的固体氧化物时,正极氧气得电子生成氧离子;当电解质为熔融碳酸盐时,正极氧气得电子结合二氧化碳生成碳酸根离子,据此分析.
解答 解:A、电解质为能够传导氧离子的固体氧化物,正极氧气得电子生成氧离子,故A不选;
B、电解质溶液是氢氧化钾,正极上氧气得电子生成氢氧根离子,故B不选;
C、电解质溶液是酸,正极上氧气和氢离子反应生成水,故C选;
D、电解质为熔融碳酸盐,正极氧气得电子结合二氧化碳生成碳酸根离子,故D不选;
故选C.
点评 本题考查了燃料电池电极反应式是书写,特别是正极电极反应式的书写,注意对基础知识的总结,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种用离子变换法回收钒的新工艺,回收率达到91.7%.
部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如图所示:
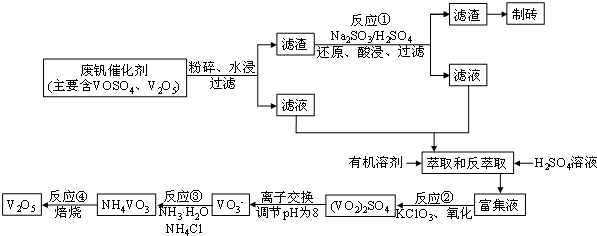
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3
用铝热剂法从下列各金属氧化物中冶炼出各1mol对应的金属,耗铝粉的质量最多的是c(填序号)
a.Fe3O4 b.Ni2O3 c.V2O5 d.MnO2
(2)反应①的化学方程式为V2O5+Na2SO3+2H2SO4=2VOSO4+Na2SO4+2H2O
(3)若反萃取使用硫酸用量过大,进一步处理会增加NH3•H2O(填化学式)的用途,造成成本增大.
(4)反应②的化学方程式为:KClO3+6VOSO4+3H2O=3(VO2)2SO4+KCl+3H2SO4,若反应①用的还原剂与反应②用的氧化剂的物质的量之比为12:7,则废钒催化剂中VOSO4和V2O5的物质的量之比为3:2.
(5)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式NH4++VO3-=NH4VO3↓
(6)用已知浓度的酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中的含钒量,已知该反应的还原产物为VO2+,氧化产物为CO2,则该反应的离子方程式为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O.
(7)钒电池是以溶于一定浓度硫酸溶液中不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极反应的活性物质,电极均为铂棒,电池总反应为:VO2++V3++H2O$?_{放电}^{充电}$V2++VO2++2H+
①放电时的正极反应为VO2++2H++e-═VO2++H2O
②充电时的阴极反应为V3++e-═V2+.
18.某有机物结构简式如图,该有机物不可能具有的性质是( )
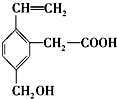

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 能发生酯化反应 | |
| C. | 能在铜作催化剂的条件下发生催化氧化 | |
| D. | 能与4mol溴单质发生加成反应 |
2.以下互为同位素的是( )
| A. | 金刚石与石墨 | B. | D2与H2 | ||
| C. | CO与CO2 | D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl |
20.下列操作能达到预期目的是( )
| A. | 检验卤代烃中是否含有氯,可将其与NaOH溶液共热后滴加AgNO3溶液即可 | |
| B. | 根据外加电源的阴极保护法,把钢闸门与外加电源的正极连接就可以被保护 | |
| C. | 将乙醇与浓的氢溴酸混合加热可以制备溴乙烷 | |
| D. | 做过银镜反应实验的试管内壁附着银,用稀氨水可以洗去 |
 CO(g)+H2(
CO(g)+H2( g)△H>0,达到平衡时,下列说法正确的是( )
g)△H>0,达到平衡时,下列说法正确的是( )
 下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证: