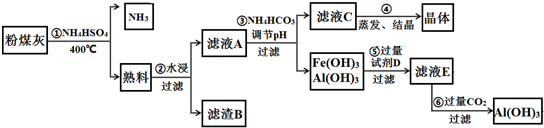
题目内容
15.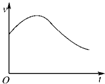 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.(1)反应开始时反应速率加快的原因是KClO3与NaHSO3反应的离子方程式为:2ClO3-+6HSO3-═6SO42-+2Cl-+6H+,开始时随着反应的进行,c(H+)不断增大.
(2)反应后期反应速率下降的原因是反应物浓度减小.
分析 由图可知,反应速率先增大,后减小,开始与氢离子浓度有关,后来与反应物浓度有关,以此来解答.
解答 解:(1)反应开始时反应速率加快,由ClO3-+3HSO3-?Cl-+3H++3SO42-可知,反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故答案为:KClO3与NaHSO3反应的离子方程式为:2ClO3-+6 HSO3-═6SO42-+2Cl-+6H+,开始时随着反应的进行,c(H+)不断增大;
(2)反应后期反应速率下降,是因随着反应的进行,反应物的浓度减少,反应速率减小,故答案为:反应物浓度减小.
点评 本题考查化学反应速率的影响因素,把握习题中的信息及浓度对反应速率的影响为解答的关键,侧重分析能力及知识应用能力的考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
10.下列说法正确的是( )
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
20.在加热情况下,用足量CO还原9g铁的氧化物,产生气体全部通入足量石灰水中得到12.5g沉淀,此铁的氧化物是( )
| A. | FeO | B. | Fe3O4 | ||
| C. | Fe2O3 | D. | Fe3O4 和Fe2O3混合物 |
7.下表中有关离子方程式的评价合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | 错误,铝元素的产物应该是AlO2- |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3•H2O+SO2═2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4++2H2O═H3O++NH3•H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
4.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)①②⑤中,最高价氧化物对应水化物,碱性最强的是KOH.
(2)②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+.
(3)①和⑨两元素形成的化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+.
(3)①和⑨两元素形成的化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
2.普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
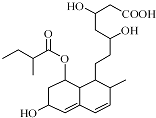

| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 不能发生加成、取代、消去反应 | |
| D. | 1mol 该物质最多可与3mol NaOH 反应 |