8.在一定条件下,将分別盛有熔融氯化钾、氯化镁、氧化铝的三个电解槽串联、通电、电解,一段时间后,得到钾、镁、铝的物质的量之比为( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
7.298 K时,N2与H2反应过程的能量变化如图所示.下列有关该反应的叙述不正确的是( )

| A. | 加人催化剂后,反应过程的能量变化可用曲线b表示 | |
| B. | 生成物的总能量小于反应物的总能量 | |
| C. | 热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 | |
| D. | 在298 K、恒容密闭容器中,通人1 mol N2和3 mol H,充分反应后放出的热量为92kJ |
6.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | B. | 使石蕊试液呈紫色的溶液 | ||
| C. | c(H+)=c(OH-)=10-6mol•L-1的溶液 | D. | 酸与碱恰好反应生成的溶液 |
5.25℃时,下列各组离子能在指定溶液中大量共存的是( )
| A. | 无色溶液:K+、Na+、MnO4-、SO42- | |
| B. | pH=11溶液:CO32-、Na+、K+、SO32- | |
| C. | 由水电离的 c(H+)=10-12 mol•L-1,溶液:Cl-、HCO3-、NO3-、Na+ | |
| D. | 酸性溶液:Fe2、NO3-、Cl-、NH4+ |
4.X+、Y2+、Z3+、W2-均为第三周期元索的简单离子,其中不影响水的电离平衡的微粒是( )
| A. | X+ | B. | Y2+ | C. | Z3+ | D. | W2- |
3.下列说法正确的是( )
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
1.如表是元素周期表的一部分,针对表中的A-J种元素,填写下列空白.
(1)元素J在周期表中的位置第四周期VⅡA族.
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为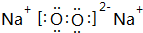 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.
(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为
 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
| 实验步骤 | 实验现象 |
| ①将E单质用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2G溶液中滴加新制的单质H的水溶液 | 2.有气体产生,溶液变成浅红色 |
| ③将一小块金属D放入滴有酚酞溶液的冷水中 | 3.剧烈反应,迅速产生大量无色气体. |
| ④将单质E投入稀盐酸中 | 4.反应开始不十分剧烈,产生无色气体. |
| ⑤将单质F投入稀盐酸中 | 5.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至过量 | 6.生成淡黄色沉淀. |
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
20.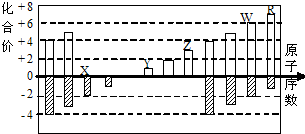 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图
(X、Y、Z、W、R代表元素符号)下列说法中,正确
的是( )
 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确
的是( )
| A. | 离子半径比较:W>R>X>Y>Z | |
| B. | W的气态氢化物的还原性和稳定性均弱于R的氢化物 | |
| C. | 工业上电解熔融的ZR3制备Z单质 | |
| D. | 含Y元素的盐溶液可能显酸性 |
19.下列说法不正确的是( )
0 169802 169810 169816 169820 169826 169828 169832 169838 169840 169846 169852 169856 169858 169862 169868 169870 169876 169880 169882 169886 169888 169892 169894 169896 169897 169898 169900 169901 169902 169904 169906 169910 169912 169916 169918 169922 169928 169930 169936 169940 169942 169946 169952 169958 169960 169966 169970 169972 169978 169982 169988 169996 203614
| A. | 向含硫燃煤中添加适量CaO可以减少SO2的排放 | |
| B. | 工业氨氧化法制HNO3,每一步都涉及氧化还原反应 | |
| C. | 用Ba(NO3)2溶液鉴别SO32-和SO42- | |
| D. | 往铜粉理逐滴加入稀盐酸,再加入NaNO3溶液后,溶液颜色无变化 |