题目内容
19.下列说法不正确的是( )| A. | 向含硫燃煤中添加适量CaO可以减少SO2的排放 | |
| B. | 工业氨氧化法制HNO3,每一步都涉及氧化还原反应 | |
| C. | 用Ba(NO3)2溶液鉴别SO32-和SO42- | |
| D. | 往铜粉理逐滴加入稀盐酸,再加入NaNO3溶液后,溶液颜色无变化 |
分析 A.向煤中掺入生石灰,在氧气参与反应和高温的条件下,用来吸收SO2,只生成硫酸钙;
B.工业氨氧化法制HNO3的反应:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;
C.SO32-和SO42-均与硝酸钡反应生成白色沉淀;
D.有氢离子有硝酸根离子,就相当于有硝酸.
解答 解:A.向煤中掺入生石灰,在氧气参与反应和高温的条件下,用来吸收SO2,只生成硫酸钙,可以减少SO2的排放,故A正确;
B.工业氨氧化法制HNO3的反应:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO,三个反应元素的化合价发生了变化,都是氧化还原反应,故B正确;
C.SO32-和SO42-均与硝酸钡反应生成白色沉淀,因此不能鉴别,故C错误;
D.有氢离子有硝酸根离子,就相当于有硝酸,铜能与硝酸反应生成硝酸铜,溶液为蓝色,故D错误.
故选CD.
点评 本题主要考查了物质的性质、工业氨氧化法制HNO3等,难度不大,注意有氢离子有硝酸根离子,就相当于有硝酸,D为易错点.

练习册系列答案
相关题目
10.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
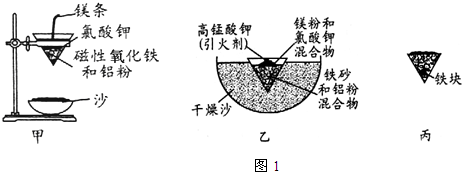
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图1甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称),所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图1甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图2所示.
几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”),原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图1甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称),所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图1甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图2所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”),原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
7.核电荷数为16的元素和核电荷数为4的原子相比较,前者的下列数据是后者的4倍的是( )
| A. | 原子半径 | B. | 最外层电子数 | C. | 电子层数 | D. | 次外层电子数 |
14.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 氮氧化合物与碳氢化合物经紫外线照射可发生反应形成有毒烟雾 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 雾霾中含有大量超标的主要物质是二氧化硫 | |
| D. | 用铝制的容器盛装浓硝酸,是因为铝和浓HNO3不反应 |
4.X+、Y2+、Z3+、W2-均为第三周期元索的简单离子,其中不影响水的电离平衡的微粒是( )
| A. | X+ | B. | Y2+ | C. | Z3+ | D. | W2- |
11.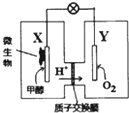 某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )
某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )
 某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )
某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )| A. | 电子从Y电极流向X电极 | |
| B. | 02在Y电极上发生氧化反应 | |
| C. | X电极的电极反应为:CH3OH+H2O-6e-═CO2↑+6H+ | |
| D. | 若1mol电子在导线中通过,则有2mol的H+通过质子交换膜 |
8.下列反应属于吸热反应的是( )
| A. | 铝粉与MnO2高温条件下反应 | B. | 碳不完全燃烧产生CO | ||
| C. | 氢氧化钡晶体与氯化铵固体混合 | D. | 盐酸与氢氧化钠溶液反应 |
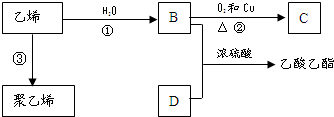 已知乙烯能发生如图转化
已知乙烯能发生如图转化 ,反应类型加聚反应.
,反应类型加聚反应.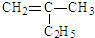
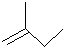
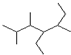 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷 ②氢氧根离子
②氢氧根离子
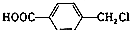 水解制得,写出K在浓硫酸作用下生成的聚合物的结构简式
水解制得,写出K在浓硫酸作用下生成的聚合物的结构简式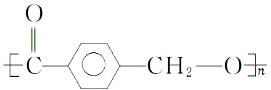 .
.