题目内容
5.25℃时,下列各组离子能在指定溶液中大量共存的是( )| A. | 无色溶液:K+、Na+、MnO4-、SO42- | |
| B. | pH=11溶液:CO32-、Na+、K+、SO32- | |
| C. | 由水电离的 c(H+)=10-12 mol•L-1,溶液:Cl-、HCO3-、NO3-、Na+ | |
| D. | 酸性溶液:Fe2、NO3-、Cl-、NH4+ |
分析 A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.pH=11的溶液为碱性溶液,四种离子之间不反应,都不与氢氧根离子反应;
C.由水电离的c(H+)=10-12 mol•L-1的溶液为酸性或碱性溶液,碳酸氢根离子能够与氢离子和氢氧根离子反应;
D.酸性溶液中,硝酸根离子能够氧化亚铁离子.
解答 解:A.MnO4-为有色离子,在溶液中不能大量存在,故A错误;
B.pH=11的溶液中存在大量氢氧根离子,CO32-、Na+、K+、SO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.由水电离的c(H+)=10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,HCO3-能够与氢离子、氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Fe2、NO3-在酸性溶液中发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
15.微粒Mn-的核外电数为x,质量数为A,则M原子核内的中子数为( )
| A. | A-x+n | B. | A-x | C. | A-x-n | D. | A-N |
20.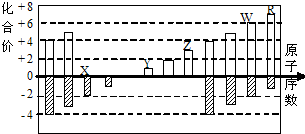 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图
(X、Y、Z、W、R代表元素符号)下列说法中,正确
的是( )
 如图是部分短周期元素化合价与原子序数的关系图
如图是部分短周期元素化合价与原子序数的关系图(X、Y、Z、W、R代表元素符号)下列说法中,正确
的是( )
| A. | 离子半径比较:W>R>X>Y>Z | |
| B. | W的气态氢化物的还原性和稳定性均弱于R的氢化物 | |
| C. | 工业上电解熔融的ZR3制备Z单质 | |
| D. | 含Y元素的盐溶液可能显酸性 |
10.反应2S02(g)+O2?2SO3(g)△H<0,下列措施能提高S02转化率的是( )
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
14.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | W元素的单质在化学反应中只表现还原性 | |
| C. | Y、Z、W的最高价氧化物均能与NaOH溶液反应 | |
| D. | X、Y的简单离子半径Y>X |
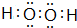 .F的原子结构示意图为:
.F的原子结构示意图为: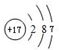 .
.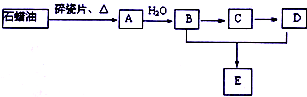 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略). ;
; ,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.