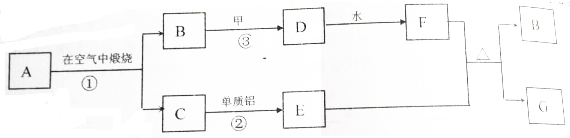
4.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:

(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
④数据处理:计算得CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
10.下列叙述中,不正确的是( )
| A. | 工业用的氯气主要是通过氯碱工业制备 | |
| B. | 金属钠、铁丝和铜丝都可以在氯气中燃烧 | |
| C. | 氢气可以在氯气中燃烧 | |
| D. | 氯气和氢气混合在强光条件下可能会发生爆炸 |
9.向10mL 1mol•L-1 AlCl3溶液中加入1mol•L-1 NaOH溶液,得到沉淀0.26g,则刚加入的NaOH溶液的体积可能为( )
0 169732 169740 169746 169750 169756 169758 169762 169768 169770 169776 169782 169786 169788 169792 169798 169800 169806 169810 169812 169816 169818 169822 169824 169826 169827 169828 169830 169831 169832 169834 169836 169840 169842 169846 169848 169852 169858 169860 169866 169870 169872 169876 169882 169888 169890 169896 169900 169902 169908 169912 169918 169926 203614
| A. | 10mL 20mL | B. | 20mL 30mL | C. | 10mL 36.7mL | D. | 20mL 36.7mL |


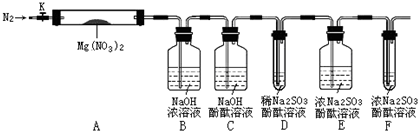
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.