题目内容
4.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
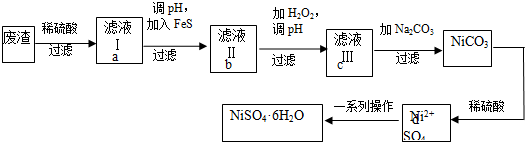
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(4)④依据方程式中各反应物量之间的关系计算CuCl的纯度.
解答 解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)FeS2中铁元素化合价+2价变化为+3价,硫元素-1价变化为+4价,失电子总数=11,氧元素化合价0价变化为-2价,氧气反应电子转移4,则最小公倍数44,电子转移为44,配平得到化学方程式为:4FeS2+11O2=8SO2+2Fe2O3 ,用单线桥法标注电子转移的方向和数目为:
故答案为: ;
;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来,
故答案为:Fe;HCl;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)④根据题目中所给数据及平行实验结果相差不能超过0.3%,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是23.9ml,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,CuCl的纯度为23.9×10-3L×0.1 mol•L-1×99.5g•mol-1/0.25g×100%=95%,
故答案为:95%.
点评 本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,注意物质性质的理解应用,题目难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-) | B. | c(H+)+c(H2RO3)=c(RO32-)+c(OH-) | ||
| C. | c(Na+)>c(HRO3-)>c(H+)>c(OH-)>c(RO32-) | D. | c(HRO3-)>c(H2RO3)>c(OH-)>c(RO32-)>c(H+) |
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂 和蛋白质都是高分子化合物 | |
| C. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| D. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 |
| A. | 10mL 20mL | B. | 20mL 30mL | C. | 10mL 36.7mL | D. | 20mL 36.7mL |
| A. | 水电离出的c(H+)=1.0×10-13mol/L的溶液中,Na+、NH4+、Cl-、SO42- | |
| B. | 滴入甲基橙试液变红色的溶液中:Cl-、AlO2-、HCO3-、NH4+ | |
| C. | 加入少量KSCN后变为红色的溶液中:K+、Mg2+、I-、NO3- | |
| D. | 无色透明的溶液中:CH3COO-、CO32-、K+、Na+ |
| A. | 分子中所有原子共平面 | B. | 碳氧原子之间含有1个α键和1个π键 | ||
| C. | 分子中既含单键又含双键 | D. | 分子中既含极性键又含非极性键 |
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O | |
| C. | 草酸使高锰酸钾溶液褪色:5H2C2O4+2MnO4-+6H+═2Mn2++10 CO2↑+8H2O | |
| D. | 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ CH3COO-+NH${\;}_{4}^{+}$+2Ag↓+3NH3+H2O |