题目内容
10.下列叙述中,不正确的是( )| A. | 工业用的氯气主要是通过氯碱工业制备 | |
| B. | 金属钠、铁丝和铜丝都可以在氯气中燃烧 | |
| C. | 氢气可以在氯气中燃烧 | |
| D. | 氯气和氢气混合在强光条件下可能会发生爆炸 |
分析 A.电解饱和食盐水生成氢氧化钠、氯气和氢气,工业上利用此原理制取氯气;
B、金属钠在氯气燃烧生成氯化钠,铜丝可以在氯气中燃烧,产生棕红色的烟,铁丝在氯气中燃烧生成红棕色烟;
C、氢气可以在氯气中燃烧生成氯化氢;
D、氯气和氢气混合在强光条件下发生剧烈反应而发生爆炸.
解答 解:A.工业上制备氯气,主要是通过电解饱和食盐水获得,故A正确;
B.金属钠在氯气燃烧生成氯化钠,铜丝可以在氯气中燃烧,产生棕红色的烟,铁丝在氯气中燃烧生成红棕色烟,所以金属钠、铁丝和铜丝都可以在氯气中燃烧,故B正确;
C、氢气可以在氯气中燃烧生成氯化氢,所以氢气可以在氯气中燃烧,故C正确;
D、氯气和氢气混合在强光条件下发生剧烈反应而发生爆炸,而不是可能会发生爆炸,故D错误;
故选D.
点评 本题考查氯气的性质,为高频考点,侧重于基础知识的考查,注意相关知识的积累,难度不大.

练习册系列答案
相关题目
20.某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
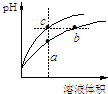

| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | a、b、c三点溶液水的电离程度a>b>c | |
| D. | 与等体积b、c处溶液反应,消耗等量的NaOH |
1.下列物质与足量铁反应,转移电子数最少的是( )
| A. | 1mol氯气 | B. | 1mol S | ||
| C. | 含1molHNO3的稀硝酸 | D. | 含1molCuSO4的硫酸铜溶液 |
5.下列实验方案可以得到白色纯净的Fe(OH)2的是( )
| A. | 在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液 | |
| B. | 用铁粉与稀硫酸充分反应,然后再加入过量的氨水 | |
| C. | 在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2和NaOH溶液的蒸馏水必须加热煮沸) | |
| D. | 在生成Fe(OH)3的悬浊液中加过量的铁粉 |
12.实验室制取乙烯的传统做法是采用浓硫酸做催化剂,由于浓硫酸具有具有脱水性和强氧性,生成乙烯同时产生CO2和SO2气体会影响乙烯的性质实验.某同学查阅相关资料后发现,可用脱水性更强的P2O5代替浓硫酸浓硫酸作为该实验的催化剂.为验证这一说法,该同学利用以下装置进行实验探究,观察并记录现象如下:

请回答下列问题:
(1)写出装置中仪器A的名称分液漏斗;
(2)装置中B、C之间长导管的作用是导气、冷凝,浓硫酸的作用是干燥气体;
(3)实验二中,完成水浴加热必需的玻璃仪器有大烧杯、酒精灯;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:P2O5溶解于乙醇,迅速放出大量的热,局部温度较高,使得少量乙醇气化,形成白雾;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是加热至较高温度.

| 实验一 | 实验二 | |
| 实验药品 | 4g P2O5、8mL无水乙醇 | |
| 实验条件 | 酒精灯加热 | 水浴加热 |
实验现象 | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇,立即产生白雾,当用酒精灯加热后,有气泡产生,并逐渐沸腾,生成粘稠状液体,集气瓶C中有无色液体产生. | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇立即产生白雾,当用水浴加热后,无气泡产生,生成粘稠状液体,集气瓶C中有无色液体产生. |
(1)写出装置中仪器A的名称分液漏斗;
(2)装置中B、C之间长导管的作用是导气、冷凝,浓硫酸的作用是干燥气体;
(3)实验二中,完成水浴加热必需的玻璃仪器有大烧杯、酒精灯;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:P2O5溶解于乙醇,迅速放出大量的热,局部温度较高,使得少量乙醇气化,形成白雾;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是加热至较高温度.
10.某有机化合物的结构简式如图所示,关于该化合物的下列说法正确的是( )
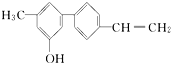

| A. | 属于芳香烃 | |
| B. | 能发生取代反应和加聚反应 | |
| C. | 分子式为C15H7O | |
| D. | 不能使溴水褪色但能与氯化铁溶液发生显色反应 |
 在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则每个晶胞中含有的氧原子数为( )
在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则每个晶胞中含有的氧原子数为( )