题目内容
1.学习小组拟通过实验,探究Mg(NO3)2受热分解的产物.小组猜想:ⅰ.固体产物可能有Mg(NO2)2、MgO、Mg3N2中的一种或几种
ⅱ.气体产物可能有NO2、N2、O2中的一种或几种
查得相关资料:a.Mg(NO2)2、Mg(NO3)2易溶于水,MgO难溶于水.
b.2NO2+2NaOH=NaNO3+NaNO2+H2O
c.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(1)针对以上猜想,设计了如图所示实验(图中加热、夹持仪器等装置均省略):
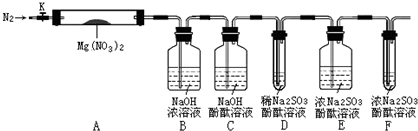
(2)进行实验
Ⅰ.检验上述装置气密性.
Ⅱ.称取3.7gMg(NO3)2固体,置入硬质玻璃管A中,打开K,通入一段时间N2,并进行相关物质质量称量
Ⅲ.关闭K,用酒精灯持续给装置A加热,过程中各装置内溶液均未倒吸入其它装置.
Ⅳ.待Mg(NO3)2完全分解,装置冷却至室温,打开K,再缓慢通入一会N2后并再称量.称得A中剩余固体质量为1.0g,B、C、D、E、F中溶液质量分别增加了2.3g、0.0g、0.1g、0.3g、0.05g.
Ⅴ.取少量剩余固体于试管中,加入适量水,未出现明显现象.
(3)回答问题
①小组预测一定有O2生成,理由是N元素化合价降低,则一定存在化合价升高的元素,只能为氧元素失去电子生成O2.
②N2的电子式是
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.③步骤Ⅲ中,装置A内若出现了红棕色气体,其化学式是NO2.
④装置C中若红色始终未褪,其设计的目的是验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验.
⑤实验中发现Mg(NO3)2分解时有O2生成,其实验现象是C中红色溶液中有气泡冒出,D中溶液褪色,用化学用语解释,产生上述现象的原因是Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2=2Na2SO4.
⑥实验中Mg(NO3)2分解没有N2生成的理由是Mg(NO3)2的质量与剩余固体、NO2、O2的质量之和相等,已符合质量守恒定律.
⑦Mg(NO3)2分解的化学方程式是2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑.
⑧装置F中溶液质量增加的原因是吸收空气进入的O2所致.
分析 ①根据氧化还原反应中化合价有升高,一定也要降低角度进行判断;
②氮气分子中含有氮氮三键,最外层满足8电子稳定结构;各装置中都有氧气,避免空气中氧气干扰实验;
③根据二氧化氮为红棕色气体分析;
④二氧化氮影响氧气的检验,所以检验氧气前先必须证明二氧化氮已经除尽;
⑤若C中红色溶液中有气泡冒出,D中溶液褪色,则证明产物中有氧气;分别写出亚硫酸钠水解、亚硫酸钠被氧气氧化的方程式;
⑥根据质量守恒进行判断;
⑦根据以上分析可知,硝酸镁分解生成氧化镁、二氧化氮和氧气,据此写出反应的方程式;
⑧空气中有氧气,能够将亚硫酸钠氧化成硫酸钠导致溶液质量增加.
解答 解:①Mg(NO3)2受热分解生成的氮化物中,N元素的化合价降低,则一定有化合价升高的元素,根据硝酸镁的组成可知,只能为-2价的氧元素失去电子生成氧气,
故答案为:N元素化合价降低,则一定存在化合价升高的元素,只能为氧元素失去电子生成O2;
②氮气分子中含有氮氮三键,氮原子最外层达到8电子稳定结构,其电子式为: ;
;
步骤Ⅱ中,通入一段时间N2,目的是用氮气排出装置中空气避免对产物氧气检验的干扰,
故答案为: ;避免对分解产物O2的检验产生干扰;
;避免对分解产物O2的检验产生干扰;
③步骤Ⅲ中,装置A内若出现了红棕色气体,则该红棕色气体为NO2,故答案为:NO2;
④装置D用于检验氧气,而二氧化氮能够氧化亚硫酸钠,影响了氧气的测定,所以必须用装置C验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验,
故答案为:验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验;
⑤若装置C中红色溶液中有气泡冒出,且试管D中亚硫酸钠的酚酞溶液褪色,则证明反应产物中有氧气,涉及的反应有:亚硫酸钠水解溶液呈碱性,所以滴有酚酞的溶液显示红色:Na2SO3+H2O?NaHSO3+NaOH、亚硫酸钠被氧化生成硫酸钠:2Na2SO3+O2=2Na2SO4,导致溶液褪色,
故答案为:C中红色溶液中有气泡冒出,D中溶液褪色;Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2=2Na2SO4;
⑥称取3.7gMg(NO3)2固体,反应后剩余1g固体,B中增重2.3g为二氧化氮质量,D、E增重的为氧气,质量为0.4g,总质量恰好为3.7g,说明反应产物中不会有氮气生成,
故答案为:Mg(NO3)2的质量与剩余固体、NO2、O2的质量之和相等,已符合质量守恒定律;
⑦取少量剩余固体于试管中,加入适量水,未出现明显现象,说明反应产物中没有氮化镁和亚硝酸镁,只能为氧化镁,结合其它分析可知,硝酸镁分解生成氧化镁、二氧化氮气体和氧气,反应方程式为:2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑,
故答案为:2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+4NO2↑+O2↑;
⑧装置F的作用是吸收空气中氧气,避免干扰实验测定,由于亚硫酸钠与空气中氧气反应生成硫酸钠,导致试管F中溶液质量增加,
故答案为:吸收空气进入的O2所致.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验原理及化学实验基本操作方法为解答关键,注意掌握物质的性质及检验方法,试题侧重考查学生的分析、理解能力及化学实验能力.

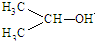 可简写为
可简写为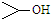 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(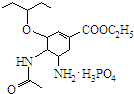 ),有关它的说法错误的是( )
),有关它的说法错误的是( )| A. | 达菲是一种磷酸盐 | |
| B. | 达菲分子中含有肽键 | |
| C. | 达菲的分子式为C16H31N2O8P | |
| D. | 1mol达菲可与2mol H2发生加成反应 |
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeI2 | I2 | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | O2 | Mn2+ |
| A. | 表中①组的反应中氧化产物一定是I2 | |
| B. | 氧化性强弱的比较:KClO3>Cl2>Fe3+>I2 | |
| C. | 表中②组每生成1molCl2,转移1mol电子 | |
| D. | 表中③组其他反应物可以为浓盐酸 |
| A. | 若生成物C和D分别为盐和水,则该反应一定是中和反应 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D不可能是两种沉淀 | |
| D. | 若A是可溶性碱,B是可溶性盐,则C和D一定是另一种碱和另一种盐 |
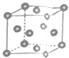
| A. | 只有金属钋原子采用这种堆积方式 | B. | 这种堆积方式中,配位数为8 | ||
| C. | 这是金属晶体的一种最密堆积方式 | D. | 这种堆积方式的空间利用率较低 |
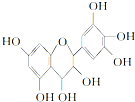
原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
| A. | 该物质既可看作醇类,也可看作酚类 | |
| B. | 1 mol该物质可与4 mol Br2反应 | |
| C. | 1 mol该物质可与7 mol NaOH反应 | |
| D. | 1 mol该物质可与7 mol Na反应 |

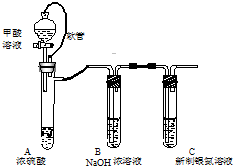 银氨溶液可用于检测CO气体,实验室研究的装置如图:
银氨溶液可用于检测CO气体,实验室研究的装置如图: