6.下列各组气体中,通常状况下能够共存,并且都能用浓硫酸干燥的是( )
| A. | HCl、N2、NH3 | B. | Cl2、CO2、O2 | C. | NO、O2、N2 | D. | SO2、CO、H2S |
5.常温下能用铁制或铝制容器盛放的是( )
| A. | 稀硝酸、稀硫酸 | B. | 硝酸银溶液 | C. | 浓硝酸、浓硫酸 | D. | 硫酸铜溶液 |
4.已知A--F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
(1)写出符合下列条件的A的同分异构体的结构简式: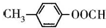 .
.
A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(2)化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是BD(填字母).
A.能与氯化铁溶液显色 B.分子中含有羧基、羟基等官能团
C.能与溴水反应 D.能与碳酸钠溶液反应产生二氧化碳
(3)化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为3mol.
(4)化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去.
反应③中D与H2按物质的量1:1反应生成Y,则反应②的化学方程式为 .
.
(5)化合物D与银氨溶液反应的化学方程式(有机物用结构简式表示):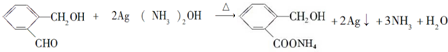 .
.
(6)化合物F是合成克矽平的原料之一,(克矽平是一种治疗矽肺病的药物),其合成路线如下(反应均在一定条件下进行):
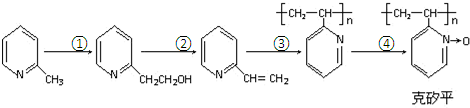
a.反应①是原子利用率100%的反应,则该反应的化学方程式为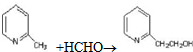 ;
;
b.上述转化关系中没有涉及的反应类型是③⑥(填代号).
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应.
| 化合物 | A | B | C |
| 结构简式 | 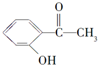 | 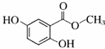 | 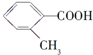 |
| 化合物 | D | E | F |
| 结构简式 |  | 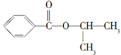 |  |
 .
.A.核磁共振氢谱有4组峰
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(2)化合物B是制取抗心律失常药物--氟卡尼的中间体,下列有关描述不正确的是BD(填字母).
A.能与氯化铁溶液显色 B.分子中含有羧基、羟基等官能团
C.能与溴水反应 D.能与碳酸钠溶液反应产生二氧化碳
(3)化合物B在一定条件下,可以与NaOH溶液发生反应,则1mol化合物B最多需要NaOH的物质的量为3mol.
(4)化合物C与D在一定条件下发生如下转化得到高分子化合物Z,部分产物已略去.

反应③中D与H2按物质的量1:1反应生成Y,则反应②的化学方程式为
 .
.(5)化合物D与银氨溶液反应的化学方程式(有机物用结构简式表示):
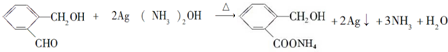 .
.(6)化合物F是合成克矽平的原料之一,(克矽平是一种治疗矽肺病的药物),其合成路线如下(反应均在一定条件下进行):

a.反应①是原子利用率100%的反应,则该反应的化学方程式为
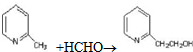 ;
;b.上述转化关系中没有涉及的反应类型是③⑥(填代号).
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应.
2.已知反应A(g)+B(g)?2C(g),B为有色气体,反应平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
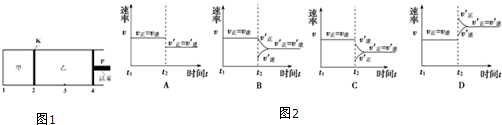
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.

1.下列图示与对应的叙述相符的是( )
| A. | 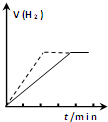 向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,如图虚线表示加入CuSO4溶液时氢气体积与时间的关系 | |
| B. | 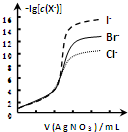 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图曲线,可确定首先沉淀的是Cl- | |
| C. | 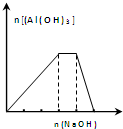 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 | |
| D. | 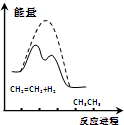 由图可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
20.从下列事实所得出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在镁铝为电极,氢氧化钠为电解质的原电池装置中,镁表面有气泡 | 金属活动性:Al>Mg |
| ④ | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
19.下列离子方程式书写不正确的是( )
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 氨水吸收足量的SO2气体:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
18.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g N2、N2O、N2O4的混合气体含有氮原子数为2NA | |
| B. | 质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | |
| C. | 0.5 mol•L-1的乙酸溶液中,乙酸分子的数目小于0.5NA | |
| D. | 78g苯分子中含有碳碳双键数为3 NA |
17.化学与人类生活密切相关,下列说法均正确的选项是( )
①漂白粉、水玻璃和铝热剂都是混合物 ②天然气和液化石油气的主要成分都是甲烷
③Fe2O3俗称铁红,用做油漆或涂料 ④食盐、醋酸和蔗糖都是电解质
⑤石油的裂解、煤的气化、橡胶的老化、海水制镁的过程都包含化学变化
⑥用牺牲阴极的阳极保护法防止金属被腐蚀.
0 169727 169735 169741 169745 169751 169753 169757 169763 169765 169771 169777 169781 169783 169787 169793 169795 169801 169805 169807 169811 169813 169817 169819 169821 169822 169823 169825 169826 169827 169829 169831 169835 169837 169841 169843 169847 169853 169855 169861 169865 169867 169871 169877 169883 169885 169891 169895 169897 169903 169907 169913 169921 203614
①漂白粉、水玻璃和铝热剂都是混合物 ②天然气和液化石油气的主要成分都是甲烷
③Fe2O3俗称铁红,用做油漆或涂料 ④食盐、醋酸和蔗糖都是电解质
⑤石油的裂解、煤的气化、橡胶的老化、海水制镁的过程都包含化学变化
⑥用牺牲阴极的阳极保护法防止金属被腐蚀.
| A. | ②④⑤ | B. | ①③⑤ | C. | ①②⑥ | D. | ③④⑥ |
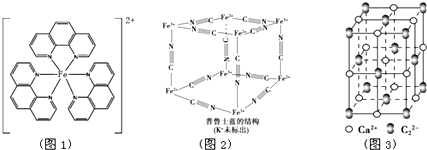
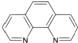 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.
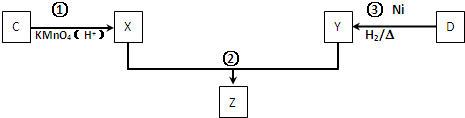
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有6个.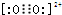 .已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.
.已知CaC2晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为$\frac{256}{a{N}_{A}}$cm3.