题目内容
1.下列图示与对应的叙述相符的是( )| A. | 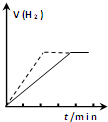 向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,如图虚线表示加入CuSO4溶液时氢气体积与时间的关系 | |
| B. | 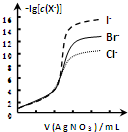 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图曲线,可确定首先沉淀的是Cl- | |
| C. | 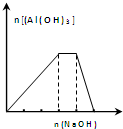 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 | |
| D. | 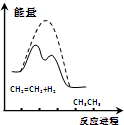 由图可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
分析 A.加入硫酸铜,锌置换出铜可加快反应速率,但生成氢气的量减少;
B.由图象可知,生成沉淀时c(Cl-)浓度最大;
C.向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,与NaOH反应的粒子依次是Al3+、NH4+、Al(OH)3;
D.加入催化剂应降低反应的活化能.
解答 解:A.向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,锌置换出铜,形成铜锌原电池反应,反应速率增大,但生成氢气的量减少,故A错误;
B.由图象可知,-lgc(X-)越大,则c(X-)越小,越先生成沉淀,由图2曲线,可确定首先沉淀的是I-,故B错误;
C.向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,生成生成氢氧化铝沉淀,然后铵根离子与氢氧根离子反应生成一水合氨,最后氢氧化铝与氢氧根离子反应生成偏铝酸根离子,图象符合,故C正确;
D.加入催化剂应降低反应的活化能,故D错误.
故选C.
点评 本题考查较为综合,涉及学生的分析能力的考查,为高考高频考点和常见题型,注意把握图象曲线的变化特点,为解答该题的关键,难度中等.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
12.下列有机化工与其产品用途不对应的是( )
| A. | 石油分馏:航空煤油 | B. | 重油裂化:导电塑料 | ||
| C. | 煤的干馏:炼铁焦炭 | D. | 乙烯水化:有机溶剂 |
9.下列有关物质的性质与应用不相对应的是( )
| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
6.下列各组气体中,通常状况下能够共存,并且都能用浓硫酸干燥的是( )
| A. | HCl、N2、NH3 | B. | Cl2、CO2、O2 | C. | NO、O2、N2 | D. | SO2、CO、H2S |
13.氯化亚砜(SOCl2,结构式如图:(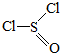 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:
SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
 )主要用于制造酰基氯化物,其工业制备原理:
)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2═SOCl2+SO2,下列有关说法正确的是( )
| A. | SCl2和SOCl2中S的化合价分别为+2、+4价 | |
| B. | 制备反应中,二氧化硫是氧化产物 | |
| C. | 每消耗1mol SCl2,转移1mol电子 | |
| D. | SOCl2分子中既含有离子键又含有共价键 |
10.用惰性电极电解硫酸铜溶液,一段时间后停止通电,向烧杯中加入9.8g氢氧化铜固体,恰好使溶液恢复到电解前组成,那么在电解过程中,转移电子数为( )
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |
1.原子序数依次递增的短周期元素X、Y、Z、W存在以下关系:①原子最外层电子数之和为20;②X与Y、Z、W位于相邻周期;③Z原子最外层电子数是Y原子最外层电子数的3倍,也是X原子内层电子数的3倍.以下判断错误的是(注:不考虑0族元素)( )
| A. | X的氢化物的水溶液呈酸性 | |
| B. | Y的氧化物和氢氧化物均不溶于水 | |
| C. | Z的最高价含氧酸的浓溶液有强氧化性 | |
| D. | W原子半径在同周期中最小 |
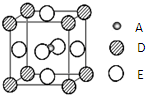 已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的原子序数为28.