8.下面是元素周期表的一部分.下列与表中元素有关的叙述正确的是( )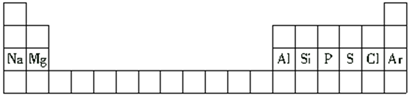

| A. | 铝是第二周期元素 | |
| B. | 氯原子的半径比硫原子的半径小 | |
| C. | 氢氧化钠的碱性比氢氧化镁的碱性弱 | |
| D. | 硅原子的最外层电子数比磷原子的最外层电子数多 |
7.分子式为C8H10O的苯的衍生物,其分子中含有两个互为对位的取代基,则其中不与NaOH 溶液反应的物质的种数为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
3.在恒温恒容条件下,向容积为2L的密闭容器中充人2mol SO2和2mol O2,已知:2SO2(g)+O2(g)?2SO2(g);△H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25a kJ.下列判断正确的是( )
| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
2.已知某反应的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为放热反应 | |
| B. | 该反应可为Ba(OH)2•8H2O与NH4Cl晶体的反应 | |
| C. | 该反应可为甲烷在氧气中的燃烧反应 | |
| D. | 该反应只有在加热条件下才能进行 |
1.现有X、Y、Z、W四种无色溶液,分别是HCl、Ba(NO3)2、Na2CO3、AgNO3中的一种.两两之间相互反应的现象(沉淀↓、气体↑)如表所示:试判断溶液X、Y、Z、W依次是( )
0 169608 169616 169622 169626 169632 169634 169638 169644 169646 169652 169658 169662 169664 169668 169674 169676 169682 169686 169688 169692 169694 169698 169700 169702 169703 169704 169706 169707 169708 169710 169712 169716 169718 169722 169724 169728 169734 169736 169742 169746 169748 169752 169758 169764 169766 169772 169776 169778 169784 169788 169794 169802 203614
| X | Y | Z | W | |
| Y | ↑ | - | ↓ | 无明显现象 |
| Z | ↓ | ↓ | - | 无明显现象 |
| A. | HCl、Na2CO3、AgNO3、Ba(NO3)2 | B. | Na2CO3、HCl、Ba(NO3)2、AgNO3 | ||
| C. | Na2CO3、HCl、AgNO3、Ba(NO3)2 | D. | AgNO3、Ba(NO3)2、HCl、Na2CO3 |
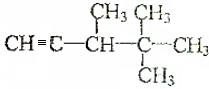

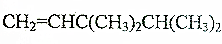
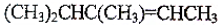
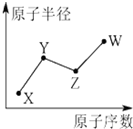 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示: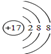 ;
;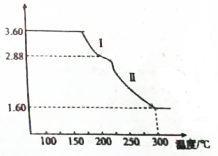 氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:
氯及其化合物在生产,生活中有着广泛的用途,回答下列问题: