题目内容
17.V mL硫酸铝溶液中含有铝元素a g,取溶液$\frac{V}{4}$mL稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是$\frac{125a}{36}$mol/L.分析 根据n=$\frac{m}{M}$计算agAl3+的物质的量,再根据$\frac{V}{4}$mL溶液中含有的Al3+的物质的量,根据化学式可知n(SO42-)=$\frac{3}{2}$n(Al3+),再根据c=$\frac{n}{V}$计算稀释后溶液中硫酸根离子的浓度.
解答 解:agAl3+的物质的量为:$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
取$\frac{V}{4}$mL溶液中含有Al3+的物质的量为:$\frac{1}{4}$×$\frac{a}{27}$mol,
故n(SO42-)=$\frac{3}{2}$n(Al3+)=$\frac{3}{2}$×$\frac{1}{4}$×$\frac{a}{27}$mol=$\frac{a}{72}$mol,
故稀释为4VmL后溶液的c(SO42-)=$\frac{\frac{a}{72}mol}{4V×1{0}^{-3}L}$=$\frac{125a}{36}$mol/L,
故答案为:$\frac{125a}{36}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,掌握物质的量浓度的表达式为解答关键,注意明确溶质化学式与含有离子之间量的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
8.根据下列某些短周期元素中元素性质的有关句回答问题.
(1)元素②、④、⑦和⑩的电负性由大到小的顺序是F>Cl>Al>Na(填元素符号).
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3(写化学式).
(3)元素⑦离子的结构示意图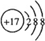 .
.
(4)元素①和⑨形成阳离子,其结构式为 ,其中心原子以sp3杂化轨道成键.
,其中心原子以sp3杂化轨道成键.
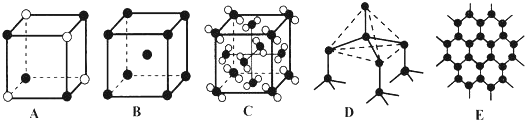
(5)元素②和⑦形成晶体的部分结构可用图中的A来表示.元素⑤最高价氧化物的晶体结构可以用下图C来表示.(填序号)
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3(写化学式).
(3)元素⑦离子的结构示意图
 .
.(4)元素①和⑨形成阳离子,其结构式为
 ,其中心原子以sp3杂化轨道成键.
,其中心原子以sp3杂化轨道成键.(5)元素②和⑦形成晶体的部分结构可用图中的A来表示.元素⑤最高价氧化物的晶体结构可以用下图C来表示.(填序号)

12.乙酸与某饱和一元醇完全反应后,生成的有机物的相对分子质量为乙酸的相对分子质量的1.7倍,则该醇可能为( )
| A. | CH3OH | B. | CH3CH2OH | C. | 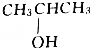 | D. | 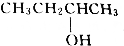 |
12.用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )
| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
9.已知:
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>O,△H3<0 | B. | △H2<0,△H4>0 | C. | △H2=△H1-△H3 | D. | △H3=△H4+△H1 |
10.对下列有关实验的描述正确的是( )
| A. | 配制银氨溶液时,将硝酸银溶液逐滴滴入氨水中 | |
| B. | 乙醇中混有乙酸,加蒸馏水,然后分液 | |
| C. | 苯中混有苯酚,加浓溴水,然后分液 | |
| D. | 溴苯中混有溴,加NaOH溶液,然后分液 |

 .
. W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示: ;
;