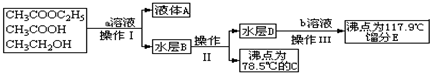
题目内容
4.有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:①将白色粉末加水溶解,得无无色溶液.
②向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B.
根据上述现象判断:
(1)A的化学式是BaCO3 B的化学式是AgCl.
(2)原白色粉末中一定含有NaHCO3、BaCl2,可能含有KCl,
对可能含有的物质,可通过焰色(填实验名称)进一步检验.检验操作步骤有:
①蘸取待测液②置于酒精灯火焰上灼烧 ③透过蓝色钴玻璃观察 ④用稀盐酸洗净铂丝.其中正确的操作顺序为C
A.①②③④B.④①②③C.④②①②③④D.①③②④
分析 无色溶液中,有色离子不能存在无FeCl3;能和氢氧化钠反应并产生白色沉淀的是碳酸氢钠以及氯化钡溶液,氯化钡溶液中含有氯离子,能和硝酸酸化的硝酸银之间反应生成氯化银白色沉淀;原溶液一定不含有硫酸钾,可能含氯化钾,根据焰色反应操作进行解答.
解答 解:(1)FeCl3溶液为棕黄色,将白色粉末加水溶解,得无色溶液,所以一定不含有FeCl3,向①中中所得的无色溶液中加入NaOH溶液并加热,仅观察到有白色沉淀A生成,则一定含有碳酸氢钠和氯化钡,碳酸氢钠可以和氢氧化钠反应得到碳酸钠,碳酸钠可以和氯化钡反应生成碳酸钡白色沉淀,过滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,即为氯化银沉淀,故答案为:BaCO3;AgCl;
(2)有白色沉淀A生成,则一定含有碳酸氢钠和氯化钡,有氯化钡就一定没有硫酸钾,白色沉淀B为氯化银沉淀,氯离子可能是氯化钡中的氯离子,不能确定是否含有KCl,钾离子的检验,可通过焰色反应检验,焰色反应的操作步骤:④用稀盐酸洗净铂丝,②置酒精灯火焰上灼烧,①蘸取待测液,②置于酒精灯火焰上灼烧,③透过蓝色钴玻璃观察火焰颜色,④用稀盐酸洗净铂丝,故C符合,
故答案为:NaHCO3、BaCl2;KCl;焰色;C.
点评 解答本题要从物质的颜色、物质之间相互作用时的实验现象等方面进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
11.下列说法中错误的是( )
| A. | 0.5 L 2 mol•L-1 AlCl3溶液中,Al3+和Cl-总数小于4×6.02×1023个 | |
| B. | 制成0.5 L 10 mol•L-1的盐酸,需要标准状况下的氯化氢气体112 L | |
| C. | 从1 L 1 mol•L-1的NaCl溶液中移取出10 mL溶液,其浓度是1 mol•L-1 | |
| D. | 10 g 98%的硫酸(密度为1.84 g•cm-3)与10 mL18.4 mol•L-1的硫酸的浓度不同 |
9.乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,浓硫酸增重2.04g,然后通过Na2O2 ,Na2O2 增重2.24g,混合气体中乙烷和丙烷的体积比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
13.下列方法或试剂不能鉴别甲烷和乙烯的是( )
| A. | 点燃 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 浓硫酸 |
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: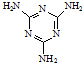 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3. 氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:
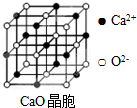
氯及其化合物在生产,生活中有着广泛的用途,回答下列问题: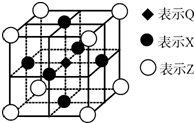 已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.