15.下列反应不可能作为原电池工作时发生的反应的是( )
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | 2Fe+O2+2H2O═2Fe(OH)2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2H2+O2═2H2O |
14.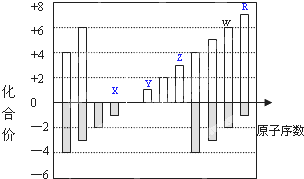 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WO3和水反应形成的化合物是离子化合物 | |
| D. | 原子半径:Z>Y>X |
13.如图,C、D,E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )
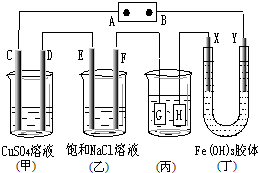

| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:02+2H20+4e-═40H- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
12.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )


| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ | |
| D. | C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为负值 |
11.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA | |
| C. | 在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
8.根据下列操作现象,下属实验目的或结论正确的是( )
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 取1ml20%蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,取少量溶液,加入少量新制的Cu(OH)2,加热,没有砖红色沉淀生成 | 蔗糖没有水解 |
| B | SO2通入Ba(NO3)2溶液,生成白色沉淀 | 生成白色Ba(SO3)2沉淀 |
| C | 铜放入稀硫酸中无明显现象,再加入硝酸钠固体,有明显的气泡冒出,溶液变蓝,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向盛有3mL约5%的H2O2溶液中加入1~2滴1mol/LFeCl3溶液;有大量气泡出现,能使带火星的火柴梗复燃 | FeCl3可以催化H2O2分解的反应速率 |
| A. | A | B. | B | C. | C | D. | D |
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,将1molN2和3molH2H混合,充分反应后转移电子数为6NA | |
| B. | 常温下,5.6gFe与足量浓硝酸作用转移电子数一定为0.3NA | |
| C. | 65gZn与一定量的浓硫酸反应至完全溶解,转移电子数一定为2NA | |
| D. | 6.4g由S2、S4、S8组成的混合物中含有硫原子的数目为0.1NA |
6.某化合物通过化合反应生成,向其溶液中加入足量Na2O2,最终有白色沉淀产生.下列化合物中符合上述条件的是( )
0 169568 169576 169582 169586 169592 169594 169598 169604 169606 169612 169618 169622 169624 169628 169634 169636 169642 169646 169648 169652 169654 169658 169660 169662 169663 169664 169666 169667 169668 169670 169672 169676 169678 169682 169684 169688 169694 169696 169702 169706 169708 169712 169718 169724 169726 169732 169736 169738 169744 169748 169754 169762 203614
| A. | Ca(HCO3)2 | B. | Na2SiO3 | C. | FeCl2 | D. | AlCl3 |
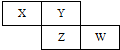 X、Y、Z、W四种短周期元素在周期表中的位置关系如图
X、Y、Z、W四种短周期元素在周期表中的位置关系如图 .
.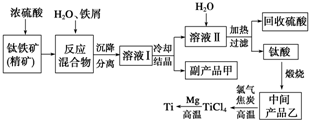 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.