题目内容
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 一定条件下,将1molN2和3molH2H混合,充分反应后转移电子数为6NA | |
| B. | 常温下,5.6gFe与足量浓硝酸作用转移电子数一定为0.3NA | |
| C. | 65gZn与一定量的浓硫酸反应至完全溶解,转移电子数一定为2NA | |
| D. | 6.4g由S2、S4、S8组成的混合物中含有硫原子的数目为0.1NA |
分析 A.氮气与氢气反应生成氨气为可逆反应,可逆反应不能进行到底;
B.常温下铁与浓硝酸发生钝化现象,阻止了反应的继续进行;
C.锌为+2价金属,65g锌的物质的量为1mol,完全反应失去2mol电子;
D.S2、S4、S8都是与S原子构成的,6.4g混合物中含有6.4gS原子,含有0.2mol硫原子.
解答 解:A.合成氨是可逆反应,1mol N2和3mol H2充分混合,反应生成的氨气小于2mol,转移的电子数小于6NA,故A错误;
B.常温下铁、铝与浓硫酸、浓硝酸发生钝化,阻止了反应的进行,故B错误;
C.65g锌的物质的量为1mol,1mol锌完全反应生成1mol锌离子,转移了2mol电子,转移电子数一定为2NA,故C正确;
D.6.4gS2、S4、S8的混合物中含有6.4gS原子,含有0.2mol硫原子,所含S原子数为0.2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确可逆反应特点,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
17.在T温度下,向2.0L恒容密闭容器中充入2.0molCO和6.0molH2O,发生如下反应:CO(g)+H2O?CO2(g)+H2(g),经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| 反应时间/s | 0 | 3 | 6 | 12 | 24 |
| n(CO2)/mol | 0 | 0.6 | 0.96 | 1.5 | 1.5 |
| A. | 反应在0~3s内的平均速率v(H2O)=0.12mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(CO2)=0.76mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,若起始时向容器中充入4.0molH2O和2.0molCO2、2.0molH2,与原平衡相比,达到平衡时,容器内压强增大 | |
| D. | 在T温度下,起始时向容器中充入2.0molH2O、1.0molCO2和1.0molH2,达到平衡时,CO2的转化率等于25% |
18.如图是某煤发电厂处理废气的原理示意图,下列说法正确的是( )
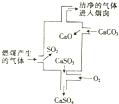

| A. | 使用此废气处理工艺不能减少SO2的排放 | |
| B. | 该过程发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用NaOH溶液检验废气处理是否达标 |
15. A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示.
A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示.
(1)将A、E两种元素的元素符号填入下表中正确的位置上.
(2)A、B、C、D、E、F六种元素中非金属性最强的是F(填元素符号),B、D量元素可以组成原子个数比为1:1的离子化合物,写出该离子化合物的电子式: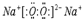 ,AB、两元素对应的气态氢化物的稳定性强弱关系是H2O>NH3(用化学式表示).
,AB、两元素对应的气态氢化物的稳定性强弱关系是H2O>NH3(用化学式表示).
(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
 A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示.
A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示.(1)将A、E两种元素的元素符号填入下表中正确的位置上.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | ----------------- | |||||||
| 二 | ||||||||
| 三 | ||||||||
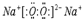 ,AB、两元素对应的气态氢化物的稳定性强弱关系是H2O>NH3(用化学式表示).
,AB、两元素对应的气态氢化物的稳定性强弱关系是H2O>NH3(用化学式表示).(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
12.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )


| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ | |
| D. | C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为负值 |
19.现代化学键理论认为苯环结构中不存在单双键交替结构,可以作为证据的事实是( )
①苯不能使KMnO4溶液褪色
②苯中碳碳键的键能均相等
③苯能在一定条件下跟H2加成生成环己烷
④经实验测得邻二甲苯仅一种结构
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色.
①苯不能使KMnO4溶液褪色
②苯中碳碳键的键能均相等
③苯能在一定条件下跟H2加成生成环己烷
④经实验测得邻二甲苯仅一种结构
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色.
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①②④⑤ |
16.已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:下列说法不正确的( )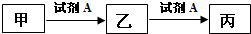
| A. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| B. | 若乙为NaHCO3,则丙一定是CO2 | |
| C. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 | |
| D. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
17.已知重铬酸钾(K2Cr2O7)是一种比高锰酸钾还要强的氧化剂,其溶液中存在如下平衡:2CrO42-(黄色)+2H +?Cr2O72-(橙色)+H2O若要使溶液的橙色加深,下列可采用的方法是( )
| A. | 加入适量稀盐酸 | B. | 加入适量稀硫酸 | ||
| C. | 加入适量烧碱固体 | D. | 加水稀释 |