题目内容
8.根据下列操作现象,下属实验目的或结论正确的是( )| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 取1ml20%蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,取少量溶液,加入少量新制的Cu(OH)2,加热,没有砖红色沉淀生成 | 蔗糖没有水解 |
| B | SO2通入Ba(NO3)2溶液,生成白色沉淀 | 生成白色Ba(SO3)2沉淀 |
| C | 铜放入稀硫酸中无明显现象,再加入硝酸钠固体,有明显的气泡冒出,溶液变蓝,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向盛有3mL约5%的H2O2溶液中加入1~2滴1mol/LFeCl3溶液;有大量气泡出现,能使带火星的火柴梗复燃 | FeCl3可以催化H2O2分解的反应速率 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水解后检验葡萄糖,应在碱性溶液中;
B.SO2通入Ba(NO3)2溶液,发生氧化还原反应;
C.Cu与稀硫酸不反应,硝酸盐在酸性溶液中具有强氧化性;
D.FeCl3加快反应速率.
解答 解:A.水解后检验葡萄糖,应在碱性溶液中,则没有在碱性溶液中加入少量新制的Cu(OH)2,加热,不能检验葡萄糖来确定是否水解,故A错误;
B.SO2通入Ba(NO3)2溶液,发生氧化还原反应,生成白色沉淀为硫酸钡,故B错误;
C.Cu与稀硫酸不反应,硝酸盐在酸性溶液中具有强氧化性,与Cu发生氧化还原反应生成NO气体,与反应速率无关,故C错误;
D.FeCl3加快反应速率,可知在反应中作催化剂,即FeCl3可以催化H2O2分解的反应速率,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、反应速率影响因素等为解答的关键,注意实验的评价性分析,侧重氧化还原反应、有机物的性质及检验等知识考查,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E所对应的元素符号或对应的微粒化学式作答)
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式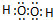 .
.
(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
| 元素 | 原色性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的原子轨道且各种原子轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式
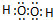 .
.(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
19.下列物质一定互为同系物的是( )
| A. | C2H4和C3H6 | B. | C2H6和C9H20 | C. | 乙醇和乙酸 | D. | 葡萄糖和果糖 |
3.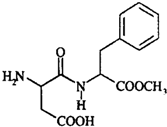 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )| A. | 阿斯巴甜属于糖类 | |
| B. | 在一定条件下完全水解,产物中有两种氨基酸 | |
| C. | 既能与酸反应又能与碱反应 | |
| D. | 可发生取代反应和加成反应 |
13.如图,C、D,E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色.则下列说法正确的是( )
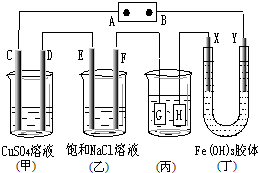

| A. | 若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:02+2H20+4e-═40H- | |
| B. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| C. | (丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷 | |
| D. | C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2 |
20.下列有关人类的营养物质,说法不正确的是( )
| A. | 蔗糖和麦芽糖是互为同分异构体,不是同系物 | |
| B. | 油脂、糖类和蛋白质在一定条件都能发生水解反应 | |
| C. | 淀粉和纤维素的水解产物都可以发生银镜反应 | |
| D. | 蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
17.某绝热恒容容器中充入2mol/LNO2,发生反应2NO2═N2 O4△H=-56.9kJ/mol 下列分析不正确的是( )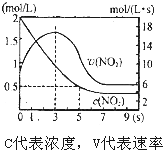

| A. | 5s 时NO2的转化率为75% | |
| B. | 0-3s 时v(NO2 )增大是由于体系温度升高 | |
| C. | 3s 时化学反应处于平衡状态 | |
| D. | 9s 时再充入N2O4,平衡后平衡常数K 较第一次平衡时大 |
18.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 12g石墨中含有C-C键的个数为3NA | |
| B. | 7.8gNa2O2晶体中含有阴阳离子总数为0.4NA | |
| C. | 1molSiO2晶体中含有2NASi-O键 | |
| D. | 28g乙烯中含π键的数目为NA |
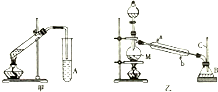 某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验.已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃.回答以下问题.
某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验.已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃.回答以下问题.