16.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol•L-1,含硝酸的浓度为1mol•L-1,现向其中加入3.2g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为( )
| A. | 89.6mL | B. | 112mL | C. | 224 mL | D. | 448mL |
15.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数约为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数约为3 NA | |
| D. | 1molNa2O2与足量CO2反应转移的电子数2NA |
14.下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
(1)以上10种元素的原子中,最容易失电子的是K(填写元素符号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式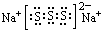 .
.
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.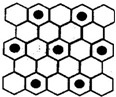
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
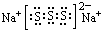 .
.(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.

12. 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
反应③的平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2.
(2)不同温度下反应②的平衡常数如表所示.则△H2< 0(填“<”“>”);
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,则CO的平衡转化率为75%.
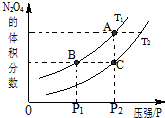
(3)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1<T2(填“>”或“<”);增大压强,平衡向正反应方向反应方向移动;B、C两点的平衡常数B>C(填“>”或“<”).
 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
反应③的平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2.
(2)不同温度下反应②的平衡常数如表所示.则△H2< 0(填“<”“>”);
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1<T2(填“>”或“<”);增大压强,平衡向正反应方向反应方向移动;B、C两点的平衡常数B>C(填“>”或“<”).
11. 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )| A. | N4和N2互为同素异形体,两者之间的转化为非氧化还原反应 | |
| B. | 1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N4分子化学性质更稳定 | |
| C. | N4气体转化为N2的热化学方程式为:N4(g)═2N2(g),△H=-882 kJ•mol-1 | |
| D. | 白磷(P4)的熔、沸点比N4分子的高 |
9.已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ•mol-1(Q>0).下列说法中正确的是( )
0 169553 169561 169567 169571 169577 169579 169583 169589 169591 169597 169603 169607 169609 169613 169619 169621 169627 169631 169633 169637 169639 169643 169645 169647 169648 169649 169651 169652 169653 169655 169657 169661 169663 169667 169669 169673 169679 169681 169687 169691 169693 169697 169703 169709 169711 169717 169721 169723 169729 169733 169739 169747 203614
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 一定量SO2(g)和O2(g)置于密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 恒温恒压下,在上述已达到平衡的体系中加入高效催化剂,SO2的转化率一定增大 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
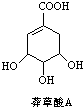 为原料的有机合成路线:
为原料的有机合成路线:
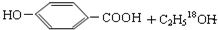 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$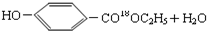 .
.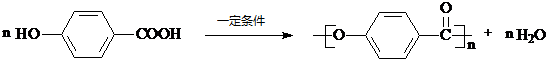 .
.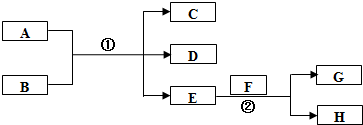
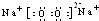 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.