题目内容
10.(1)在某温度下,把1.00mol NH3溶于水中配成1.00L溶液,测得溶液中OH-浓度和时间的图象如图1: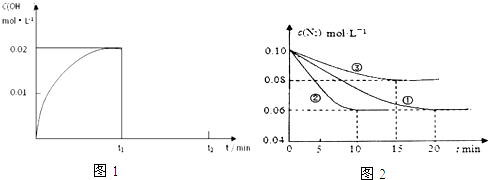
①求该温度时,氨水的电离平衡常数K=4.00×10-4.
②在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线.
(2)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为:
N2(g)+3H2(g)?2NH3(g)△H<0.在lL密闭容器中加入0.1molN2和0.3molH2,实验①、②、③中c(N2)随时间(t)的变化如图2所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=0.008mol•L-1•min-1;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的e、b(填字母编号).
a.增大压强b.减小压强C.升高温度d.降低温度e.使用催化剂.
分析 (1)①依据电离平衡常数概念及表达式列式计算;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小;
(2)根据v=$\frac{△c}{△t}$计算反应速率,根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,①和③比较可知,③的速率比①小,平衡时氮气的浓度高,即平衡逆向移动,故③减小了压强.
解答 解:(1)①在某温度下,把1.00mol NH3溶于水中配成1.00L溶液,测得溶液中OH-浓度和时间的图象中平衡状态下氢氧根离子浓度为0.02mol/L,则该温度下氨水平衡常数K=$\frac{0.02mol/L×0.02mol/L}{1mol/L-0.02mol/L}$=4.00×10-4,
故答案为:4.00×10-4;
②在t1时刻再加入H2O配成2L溶液,加水稀释氢氧根离子浓度减小,一水合氨是弱电解质存在电离平衡,促进电离氢氧根离子略增加,于t2时刻重新达到平衡氢氧根离子浓度减小,据此画出的图象为: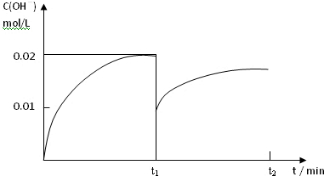 ,
,
故答案为: ;
;
(2)根据像可知,②在10min时达到平衡,此时氮气的浓度变化为0.04mol/L,根据方程式或知,氨气的浓度变化了0.08mol/L,
则:v(NH3)=$\frac{0.08mol/L}{10min}$=0.008mol•L-1•min-1;
根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,故e正确;①和③比较可知,③的速率比①小,平衡时氮气的浓度高,即平衡逆向移动,故③升减小了压强,故b正确,
故答案为:0.008mol•L-1•min-1;e;b.
点评 本题主要考查弱电解质的电离平衡及其影响、物质的量或浓度随时间的变化曲线、化学平衡的影响因素、化学反应速率的影响因素等知识,题目难度中等,试题知识点较多、综合性较强,答题时注意电解质溶液基础知识的灵活运用.

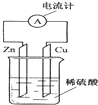
| A. | 电子由铜片通过导线流向锌片 | B. | 锌片逐渐溶解 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
| A. | a g | B. | 0.5a g | C. | 4.4a g | D. | 1.8a g |
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数约为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数约为3 NA | |
| D. | 1molNa2O2与足量CO2反应转移的电子数2NA |
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
| A. | 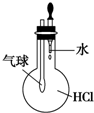 验证HCl的溶解性 | B. | 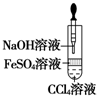 制备Fe(OH)2 | ||
| C. | 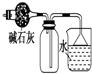 干燥并收集NH3 | D. | 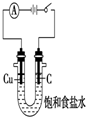 利用电解法制H2和Cl2 |
| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |


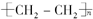 .
.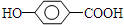 ,写出M在催化剂作用下缩聚为高分子化合物的反应方程式
,写出M在催化剂作用下缩聚为高分子化合物的反应方程式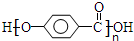 +(n-1)H2O.另有有机物N在浓硫酸存在下,两分子相互作用生成一种环状酯
+(n-1)H2O.另有有机物N在浓硫酸存在下,两分子相互作用生成一种环状酯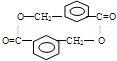 ,则有机物N的结构简式为:
,则有机物N的结构简式为: .M溶液既能和Na反应,又能和NaOH溶液反应,写出M与Na反应的反应方程式:
.M溶液既能和Na反应,又能和NaOH溶液反应,写出M与Na反应的反应方程式: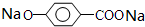 +H2↑.
+H2↑.