题目内容
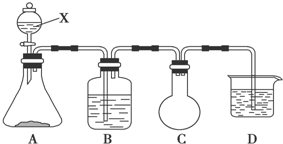
13. 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:(1)图中D装置在实验中的作用是防止倒吸.
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开F后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为2H2S+O2=2S↓+2H2O.
(3)若A为浓盐酸,B力KMnO4,C中盛有KI淀粉溶液,旋开F后,C中的现象是
溶液变蓝;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(强酸),写出该反应的离子反应方程式5Cl2+I2+6H2O═10Cl-+2IO3-+12H+.
(4)若A为浓氨水,B为生石灰,C中盛有AICl3溶液,旋开F,足够长的时间后,C中的现象是有白色沉淀生成,C中发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
(5)若B为块状大理石,C为C6H5ONa溶液,实验中观察到溶液变浑浊,则
①酸A不宜用下列的C.(填序号)
A.HCl B.HNO3 C.H2SO4 D.CH3COOH
②然后向烧杯中加入沸水,可观察到的现象是溶液变澄清.
分析 (1)如生成气体极易溶于C中液体,则D可起到防止倒吸作用;
(2)双氧水在二氧化锰催化作用下分解生成氧气,氧气氧化性强于硫,能够与硫化氢反应生成硫单质;
(3)浓盐酸与高锰酸钾反应生成氯气,氯气与碘化钾发生氧化还原反应生成碘,碘遇到淀粉变蓝;氯气过量会把碘单质氧化为碘酸盐,依据原子守恒和电荷守恒配平书写离子方程式;
(4)浓氨水滴加到生石灰生成氨气溶于水呈碱性,与氯化铝反应生成氢氧化铝沉淀;
(5)若B为块状大理石,C为C6H5ONa溶液,二者反应生成二氧化碳,二氧化碳与水反应生成碳酸,与苯酚钠反应生成苯酚沉淀,结合二氧化碳的制备解答;
苯酚低温时溶解度小,温度超过68度能够与水混溶.
解答 解:(1)如生成气体极易溶于C中液体,则C中液体上升,因C的球形部分体积较大,当C中液体脱离液面时,由于自身重力作用可回落到C中,从而可起到防止倒吸作用,
故答案为:防倒吸;
(2)双氧水在二氧化锰催化作用下分解生成氧气,氧气氧化性强于硫,能够与硫化氢反应生成硫单质,反应的方程式:2H2S+O2=2S↓+2H2O;
故答案为:2H2S+O2=2S↓+2H2O;
(3)浓盐酸与高锰酸钾反应生成氯气,氯气与碘化钾发生氧化还原反应生成碘,碘遇到淀粉变蓝;
氯气过量时,过量的氯气会将碘单质氧化生成碘酸,反应的离子方程式为:5Cl2+I2+6H2O═10Cl-+2IO3-+12H+;
故答案为:溶液由无色变为蓝色;5Cl2+I2+6H2O═10Cl-+2IO3-+12H+;
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开F,AB中浓氨水中溶解氧化钙放热,氨气挥发出来,通入氯化铝溶液中足够长的时间后,反应生成白色氢氧化铝沉淀和氯化铵,氢氧化铝难溶于氨水溶液,C中的现象是产生白色沉淀,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
故答案为:产生白色沉淀;Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
(5)①若B为块状大理石,C为C6H5ONa溶液,二者反应生成二氧化碳,二氧化碳与水反应生成碳酸,与苯酚钠反应生成苯酚沉淀,实验室制备二氧化碳不能使用稀硫酸,应为硫酸与碳酸钙反应生成微溶物硫酸钙,附着在碳酸钙的表面,阻止反应继续进行;
故选:C;
②苯酚低温时溶解度小,温度超过68度能够与水混溶,所以加入沸水后,苯酚溶解度增大,溶液变澄清;
故答案为:溶液变澄清.
点评 本题考查了实验探究物质性质的分析应用,熟练掌握物质性质是解题关键,侧重于学生的分析能力和实验能力的考查,题目难度不大.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 碳纤维增强复合材料可用于人体组织中韧带的制作 | |
| B. | 氮化硅陶瓷是新型无机非金属材料 | |
| C. | 银、铜、铁都是有色金属材料 | |
| D. | 碳化硅陶瓷具有压电效应 |
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$溶液$\stackrel{硝酸钡溶液}{→}$白色沉淀$\stackrel{稀硝酸}{→}$沉淀不溶解 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr2: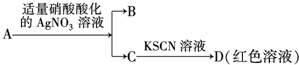 |
| A. | 将水加热到100℃,pH=6:c(H+)>c(OH-) | |
| B. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| C. | 0.1mol•L-1 的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 同浓度的三种溶液:①CH3COONH4②NH4Cl③NH3•H2O中,c(NH4+)由大到小的顺序是②③① |
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用铜为电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2+2OH- | |
| C. | 氨水溶解氯化银固体:AgCl+2NH3•H2O═[Ag(NH3)2]++Cl-+2H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
 (Ⅰ)采用系统命名法:写出下列各烃的名称
(Ⅰ)采用系统命名法:写出下列各烃的名称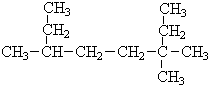 ,3,3,6-三甲基辛烷
,3,3,6-三甲基辛烷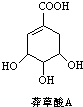 为原料的有机合成路线:
为原料的有机合成路线: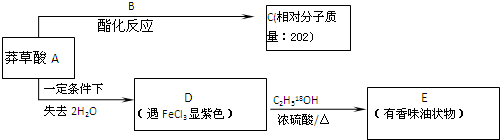
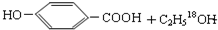 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$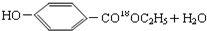 .
.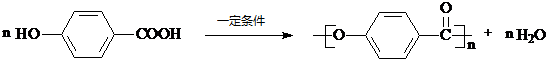 .
.