题目内容
9.已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ•mol-1(Q>0).下列说法中正确的是( )| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 一定量SO2(g)和O2(g)置于密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 恒温恒压下,在上述已达到平衡的体系中加入高效催化剂,SO2的转化率一定增大 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
分析 A、该反应正反应是放热反应,反应物的总能量大于生成物的总能量;
B、依据焓变结合热化学方程式计算判断;
C、催化剂只改变反应速率,不改变平衡移动;
D、反应是可逆反应,不能进行完全.
解答 解:A、反应是放热反应,相同条件下,2molSO2(g)和1molO2(g)所具有的能量大于2molSO3(g)所具有的能量,所以2 mol SO2(g)和1 mol O2(g)的键能之和小于2 mol SO3(g)的键能,故A错误;
B、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,参加反应的二氧化硫为2mol,故一定有2molSO2(g)被氧化,故B正确;
C、催化剂只改变反应速率,不改变平衡移动,所以加入高效催化剂,SO2的转化率不变,故C错误;
D、将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,放出热量小于QkJ,故D错误;
故选B.
点评 本题考查了热化学方程式的应用、化学平衡的影响因素等,关键是可逆反应的焓变的意义理解.

练习册系列答案
相关题目
20.铜是人类最早发现和使用的金属之一,铜及其合金的用途广泛.粗铜中含有少量铁、锌、镍、银、金等杂质,工业上可用电解法精炼粗铜制得纯铜,下列叙述正确的是( )(已知:氧化性Fe2+<Ni2+<Cu2+)
| A. | 粗铜作阳极,其电极反应式:Cu2++2e-=Cu | |
| B. | 电解过程中,电解质溶液中c(Cu2+)不变 | |
| C. | 电解后,阴极上还附有极少量的Fe和Ni | |
| D. | 电解后,可用阳极泥来提炼金、银等贵金属 |
17.乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )

| A. | 与金属钠作用时,键①断 | |
| B. | 燃烧时,①②③④⑤键均断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和③断裂 |
14.下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
(1)以上10种元素的原子中,最容易失电子的是K(填写元素符号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式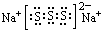 .
.
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.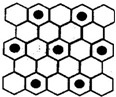
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
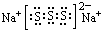 .
.(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.

1.将15.6g Na2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体8.96L,若反应过程中溶液体积保持不变,则( )
| A. | 反应过程中得到6.72 L的气体(标况) | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=2.0 mol/L |
8.下列有关工业生产叙述正确的是( )
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题: 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.