3.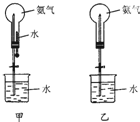 制取氨气并完成喷泉实验(图中夹持装置均以略去)
制取氨气并完成喷泉实验(图中夹持装置均以略去)
(1)写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)收集氨气使用向下排空气方法,要得到干燥的氨气可选用碱石灰做干燥剂.
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水.该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小.
(4)如果只提供乙图装置,请设计引发喷泉的方法打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉.
(5)现将甲中的NH3和水换成下列气体和液体,不能全部充入上述装置中的选项是,并说明理由(可不填满):
①选项是A,理由是二氧化氮与水反应有会有一氧化氮气体生成,能形成喷泉,但不能充满;
②选项是C,理由是氯气不溶于饱和氯化钠溶液;
③选项是.,理由是.;
④选项是.,理由是..
 制取氨气并完成喷泉实验(图中夹持装置均以略去)
制取氨气并完成喷泉实验(图中夹持装置均以略去)(1)写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)收集氨气使用向下排空气方法,要得到干燥的氨气可选用碱石灰做干燥剂.
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水.该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小.
(4)如果只提供乙图装置,请设计引发喷泉的方法打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉.
(5)现将甲中的NH3和水换成下列气体和液体,不能全部充入上述装置中的选项是,并说明理由(可不填满):
| 气体 | 液体 | |
| A | NO2 | 水 |
| B | CO2 | 4mol•L-1NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
②选项是C,理由是氯气不溶于饱和氯化钠溶液;
③选项是.,理由是.;
④选项是.,理由是..
1.砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 可以存在-3、+5等多种化合价 |
18.将2.1gMg~Al混合物投入到足量的盐酸中产生2240mL H2(标准状况),然后加入1mol/L NaOH溶液充分反应后,过滤、洗涤、干燥后固体的质量不可能为( )
| A. | 3.0g | B. | 3.5g | C. | 5.5g | D. | 5.6g |
17.据下列事实得出的结论正确的是( )
| A. | 试液→(KSCN溶液)→颜色无变化→(+氯水)→溶液变成血红色,证明溶液中含有Fe2+ | |
| B. | 试液→(焰色反应)→产生黄色,证明溶液为氢氧化钠溶液 | |
| C. | 试液→(+石蕊)→溶液呈蓝色,证明试液一定是碱溶液 | |
| D. | 混合气体→(通过澄清石灰水)→变浑浊,证明混合气体中一定含有二氧化碳 |
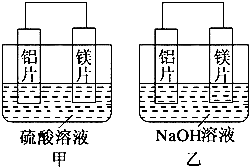
16.关于下列装置说法正确的是( )
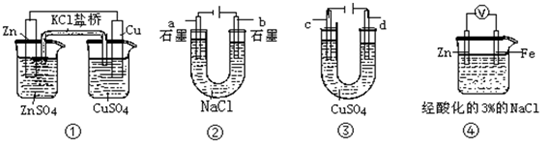

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②在电解开始阶段,b极附近溶液的pH增大 | |
| C. | 可以用装置③在银上镀铜,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
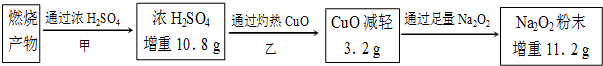
13.氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).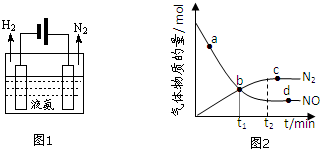
a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
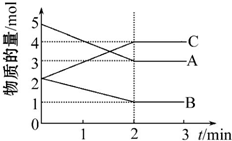
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
则合成氨反应:N2(g)+3H2 (g)═2NH3(g)△H=-90.8kJ•mol-1
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
0 169373 169381 169387 169391 169397 169399 169403 169409 169411 169417 169423 169427 169429 169433 169439 169441 169447 169451 169453 169457 169459 169463 169465 169467 169468 169469 169471 169472 169473 169475 169477 169481 169483 169487 169489 169493 169499 169501 169507 169511 169513 169517 169523 169529 169531 169537 169541 169543 169549 169553 169559 169567 203614
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).

a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |