题目内容
1.砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 可以存在-3、+5等多种化合价 |
分析 A.As位于第VA族,第VA族元素除了氮气外其余单质通常状况下都是固体;
B.同一主族元素,元素的单质的还原性随着原子序数增大而增强;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一主族元素化合价具有相似性.
解答 解:A.As位于第VA族,第VA族元素除了氮气外其余单质通常状况下都是固体,所以As在通常状况下是固体,故A正确;
B.同一主族元素,元素的单质的还原性随着原子序数增大而增强,所以砷的还原性比磷强,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P>As,所以As2O5对应水化物的酸性比H3PO4弱,故C正确;
D.同一主族元素化合价具有相似性,P有+5价、-3价等化合价,所以As可以存在-3、+5等多种化合价,故D正确;
故选B.
点评 本题考查元素周期律,明确同一主族元素性质相似性及递变性即可解答,知道非金属性强弱与其最高价氧化物的水化物酸性强弱关系,题目难度不大.

练习册系列答案
相关题目
10.下列说法中正确的是( )
| A. | 离子组K+、Fe2+、NO3-、I-因发生氧化还原反应而不能大量共存 | |
| B. | 离子组K+、Na+、ClO-、Cl-中加入稀硫酸后还能够大量共存 | |
| C. | 过量SO2通入氨水的反应为SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| D. | Na2CO3溶液显碱性的原因主要是CO32-+H20?HCO3-+OH- |
11.高分子材料与一般金属材料相比,优越性是( )
| A. | 强度大 | B. | 电绝缘性能好 | C. | 不耐化学腐蚀 | D. | 不耐热 |
6.能证明氯化氢是共价化合物的现象是( )
| A. | 氯化氢极易溶于水 | B. | 液态氯化氢不能导电 | ||
| C. | 氯化氢在水溶液中完全电离 | D. | 氯化氢是无色有刺激性气味的气体 |
13.某基态原子的外围电子排布为4d15s2,则下列说法正确的是( )
| A. | 该元素位于周期表第5周期第IB族 | B. | 该元素原子核外有5个电子层 | ||
| C. | 该元素原子最外层共有3个电子 | D. | 该元素原子M层上共有8个电子 |
10.体积为V mL,密度为ρg•mL-1的含有相对分子质量为M的某物质的溶液,其中溶质为mg,其物质的量浓度为C mol•L-1,溶质的质量分数w%,则下列表示正确的是( )
| A. | C=$\frac{1000wρ}{M}$ | B. | w%=$\frac{CM}{1000ρ}$% | C. | C=$\frac{m}{VM}$ | D. | m=$\frac{V•ρw}{100}$ |
11.依他尼酸结构简式如图所示,它是一种在体育比赛中被禁用的兴奋剂,下列有关叙述正确的是( )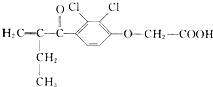

| A. | 依他尼酸属于芳香族化合物,分子式为C13H12Cl2O4 | |
| B. | 依他尼酸分子中的所有原子可能共平面 | |
| C. | 1 mol依他尼酸与足量NaOH溶液共热反应,最多消耗3 mol NaOH | |
| D. | 1 mol依他尼酸与足量H2在Ni粉存在下加热反应,最多消耗6 mol H2 |
