题目内容
18.将2.1gMg~Al混合物投入到足量的盐酸中产生2240mL H2(标准状况),然后加入1mol/L NaOH溶液充分反应后,过滤、洗涤、干燥后固体的质量不可能为( )| A. | 3.0g | B. | 3.5g | C. | 5.5g | D. | 5.6g |
分析 解法一:镁离子、铝离子转化成沉淀时结合的氢氧根离子与生成氢气转移的电子的物质的量相等,据此可计算出沉淀中氢氧根离子的物质的量,再根据计算的质量计算出生成沉淀的最大质量即可;
解法二:设出镁和铝的物质的量,分别根据总质量、生成氢气的量列式计算出二者的物质的量;当氢氧化钠过量时,沉淀只有氢氧化镁此时沉淀的质量最小;当氢氧化钠适量,镁离子和铝离子恰好生成氢氧化镁、氢氧化铝沉淀,此时沉淀的质量最大,据此得出生成沉淀的质量范围,然后对选项进行判断.
解答 解:解法-:标况下2240mL H2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,生成0.1mol氢气需要得到电子的物质的量为:0.1mol×2=0.2mol,
根据关系式可得:Mg~2e-~Mg2+~2OH-、Al~3e-~Al3+~3OH-,镁离子和铝离子完全转化成沉淀时,结合氢氧根离子的物质的量=电子的总物质的量=0.2mol,
则生成沉淀的最大质量为:2.1g+17g/mol×0.2mol=5.5g,即:生成沉淀的总质量≤5.5g,故D不可能,
故选D;
解法二:设混合物中含有Mg、Al的物质的量分别为x、y,
根据总质量可得:①24x+27y=2.1g,
标况下2240mL H2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
根据电子守恒及氢气的物质的量可得:②2x+3y=0.1mol×2,
联立①②可得:x=0.05mol、y=$\frac{1}{30}$mol,
即:混合金属中含有0.05molMg、$\frac{1}{30}$molAl,
当氢氧化钠过量时,铝离子完全转化成偏铝酸根离子,生成的沉淀只有氢氧化镁,此时生成沉淀的质量最小,则沉淀的最小质量为:58g/mol×0.05mol=2.9g;
当氢氧化钠适量,铝离子和镁离子恰好生成沉淀,此时生成沉淀的质量最大,则生成沉淀的最大质量为:2.9g+78g/mol×$\frac{1}{30}$mol=5.5g,
所以生成沉淀的质量范围为:2.9<m≤5.5g,
选项中不可能的为D,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律、讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
| A. | 二氧化碳增多使太阳辐射到地球表面的能量增多 | |
| B. | 二氧化碳等气体能释放能量,使大气层的温度升高 | |
| C. | 氟氯烃等大量排放,破坏臭氧层引起的 | |
| D. | 二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
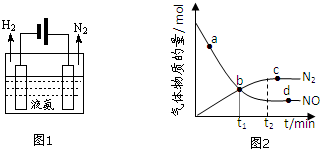
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
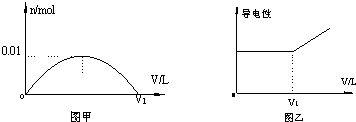
①能说明该反应已达到平衡状态的标志是bc(不定项选择).
a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
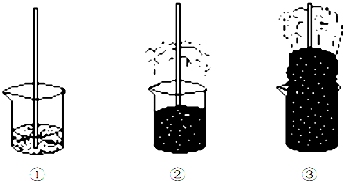
| A. | ②中现象说明浓硫酸具有很强的脱水性 | |
| B. | ③中现象说明浓硫酸具有很强的酸性 | |
| C. | ③中生成刺激性气味气体说明浓硫酸具有很强的氧化性 | |
| D. | ③中产生的气体通入品红溶液,可以观察到红色褪去 |
| A. | 铝与CuSO4溶液反应:3Al+2Cu2+═2Cu+3Al3+ | |
| B. | 向Ba(OH)2溶液中加过量NaHCO3溶液:HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| C. | 澄清石灰水与盐酸反应:H++OH-=H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═4NH4++Al(OH)4- |
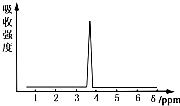 在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.