19.在一定温度下的2L密闭容器中,发生反应:2SO2(g)+O2(g)═2SO3(g);△H<0,n(O2)随时间的变化如表:
(1)反应在第五分钟时已达(填“已达”或“未达”)平衡状态.
(2)用SO2表示0?4min内该反应的平均速率为0.025mol•L-1•min-1.
(3)若升高温度,则SO2的反应速率变大(填“变大”、“变小”或“不变”).
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
(2)用SO2表示0?4min内该反应的平均速率为0.025mol•L-1•min-1.
(3)若升高温度,则SO2的反应速率变大(填“变大”、“变小”或“不变”).
15.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素⑦位于第3周期ⅤA族 | |
| B. | 元素⑤⑥形成的化合物是共价化合物 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物碱性最强 |
14.下列有关元素周期表及应用叙述正确的是( )
| A. | 周期表中的族分为主族、副族、0族和第VIII族,共18个族 | |
| B. | 凡单原子形成的离子,其核外电子排布一定符合0族元素原子的核外电子排布 | |
| C. | 俄罗斯专家首次合成了${\;}_{116}^{176}$X原子,116号元素位于元素周期表中第七周期第ⅥA族 | |
| D. | 根据主族元素最高正价与族序数的关系,推出卤族元素最高正价都是+7 |
13.关于右边一组图示的说法中错误的是( )
| A. |  用图实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图实验可用于比较铝、铁的金属性的强弱 | |
| C. |  图表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| D. | 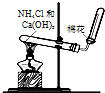 图装置可用于实验室制取氨气 |
12.下列关于化学用语表示正确的是( )
| A. | 四氯化碳电子式: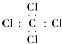 | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: | |
| D. | HClO的结构式:H-Cl-O |
11.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{H_{2}SO_{4}浓}$ CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备l,2-二溴乙烷的装置如图:

有关数据列表如下:
回答下列问题:
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)下层.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞
(6)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过( ①)反应制得( ②),②通过( ③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型) ② (填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式
(填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式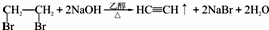 .
.
0 169291 169299 169305 169309 169315 169317 169321 169327 169329 169335 169341 169345 169347 169351 169357 169359 169365 169369 169371 169375 169377 169381 169383 169385 169386 169387 169389 169390 169391 169393 169395 169399 169401 169405 169407 169411 169417 169419 169425 169429 169431 169435 169441 169447 169449 169455 169459 169461 169467 169471 169477 169485 203614

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在装置c中应加入③(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)下层.
(4)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞
(6)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过( ①)反应制得( ②),②通过( ③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①消去反应(填反应类型) ②
 (填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式
(填该物质的电子式)③加成反应(填反应类型)写出第一步的化学方程式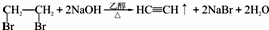 .
. 
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 .
.