题目内容
14.下列有关元素周期表及应用叙述正确的是( )| A. | 周期表中的族分为主族、副族、0族和第VIII族,共18个族 | |
| B. | 凡单原子形成的离子,其核外电子排布一定符合0族元素原子的核外电子排布 | |
| C. | 俄罗斯专家首次合成了${\;}_{116}^{176}$X原子,116号元素位于元素周期表中第七周期第ⅥA族 | |
| D. | 根据主族元素最高正价与族序数的关系,推出卤族元素最高正价都是+7 |
分析 A、VIII族包含8、9、10共3个纵行,共18个纵行;
B、H+核外没有电子;
C、由原子原子结构示意图,根据电子层数判断周期数,根据价电子判断所属族数,然后确定在周期表中的位置;
D、主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外.
解答 解:A、VIII族包含8、9、10共3个纵行,共18个纵行,共16个族,故A错误;
B、H+核外没有电子,与稀有气体元素原子的核外电子排布不同,故B错误;
C、由原子原子结构示意图,根据电子层数判断周期数,116号元素位于元素周期表中第七周期ⅥA族,故C正确;
D、主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外,所以卤族元素中除了F元素外其它元素最高正化合价为+7,故D错误;
故选C.
点评 本题考查原子结构和元素的性质,题目难度中等,本题易错点为D,注意卤族元素中除了F元素外其它元素最高正化合价为+7.

练习册系列答案
相关题目
4.等质量的下列物质中,含分子个数最多的是( )
| A. | Na2O2 | B. | CO2 | C. | H2 | D. | Cl2 |
5.C2HF3ClBr的同分异构体有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
2.已知:2Fe2++Br2=2Fe3++2Br-二现向1L某浓度的FeBr2溶液中,缓缓通入0.3molCl2至反应完全后,测出溶液中Br-和Cl-的物质的量浓度之比为1:2,则溶液中发生反应的离子方程式为( )
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 4Fe2++2Br-+3Cl2═Br2+4Fe3++6Cl- | |
| D. | 2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
9.下列化学用语表示正确的是( )
| A. | 氟化氢的电子式:H+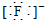 | B. | 氯原子的结构示意图: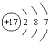 | ||
| C. | 乙酸的分子式:CH3COOH | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
19.在一定温度下的2L密闭容器中,发生反应:2SO2(g)+O2(g)═2SO3(g);△H<0,n(O2)随时间的变化如表:
(1)反应在第五分钟时已达(填“已达”或“未达”)平衡状态.
(2)用SO2表示0?4min内该反应的平均速率为0.025mol•L-1•min-1.
(3)若升高温度,则SO2的反应速率变大(填“变大”、“变小”或“不变”).
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
(2)用SO2表示0?4min内该反应的平均速率为0.025mol•L-1•min-1.
(3)若升高温度,则SO2的反应速率变大(填“变大”、“变小”或“不变”).
3.2015年4月22日是第46个世界地球日.今年地球日主题为“珍惜地球资源 转变发展方式--提高资源利用效益”.下列行为符合活动主题的是( )
| A. | 到大草原去开荒种地 | |
| B. | 更新采煤、采油技术,提高产量以满足工业生产的快速发展. | |
| C. | 落实资源的“3R”发展观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) | |
| D. | 为粮食增产,多施用高效化肥、农药 |
4.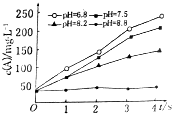 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )| A. | 若增大压强,该反应的反应速率一定增大 | |
| B. | pH=6.8时,随着反应的进行反应速率逐渐增大 | |
| C. | 一定pH范围内,溶液中H+浓度越小反应速率越快 | |
| D. | 可采用调节pH的方法使反应停止 |
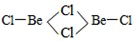 .
.