14.已知:H2O(g)=H2O(l)△H=Q1 kJ/mol
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3kJ/mol
若使46克酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3kJ/mol
若使46克酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | ( Q1+Q2+Q3 ) kJ | B. | 0.5( Q1+Q2+Q3 ) kJ | ||
| C. | ( 0.5Q1-1.5Q2+0.5Q3 ) kJ | D. | ( 3Q1-Q2+Q3 ) kJ |
13.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1 mol NH2- 含有9 NA个电子 | |
| B. | 1.8 g的NH4+离子中含有的电子总数为NA | |
| C. | 0℃时,44.8L SO3含有的氧原子数为6 NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
11.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LCH4和CH2C12的混合物所含分子数为NA | |
| B. | 用含0.2mo1 FeC13的饱和溶液制得胶体,其中所含氢氧化铁胶粒的数目为0.2 NA | |
| C. | 由NO2和CO2组成的混合气体中共有NA个分子,其中氧元素的质量一定为32g | |
| D. | 2LpH=1的HA酸溶液与足量锌粒反应,生成H2的分子数一定为0.1 NA |
9.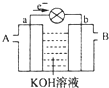 如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
0 169229 169237 169243 169247 169253 169255 169259 169265 169267 169273 169279 169283 169285 169289 169295 169297 169303 169307 169309 169313 169315 169319 169321 169323 169324 169325 169327 169328 169329 169331 169333 169337 169339 169343 169345 169349 169355 169357 169363 169367 169369 169373 169379 169385 169387 169393 169397 169399 169405 169409 169415 169423 203614
 如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )| A. | a电极发生还原反应,b电极发生氧化反应 | |
| B. | a电极的电极反应式为:CO+4OH-+2e-=CO2+2H2O | |
| C. | A处通入的是空气,B处通入的是CO | |
| D. | 用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L |

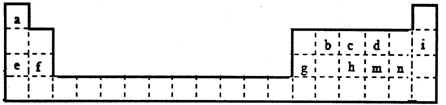
 短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: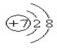 ,元素D位于元素周期表的第ⅥA族.
,元素D位于元素周期表的第ⅥA族. +2
+2 →
→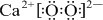 .
.
 .
.