题目内容
9.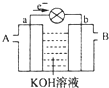 如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )
如图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极.下列叙述中,正确的是( )| A. | a电极发生还原反应,b电极发生氧化反应 | |
| B. | a电极的电极反应式为:CO+4OH-+2e-=CO2+2H2O | |
| C. | A处通入的是空气,B处通入的是CO | |
| D. | 用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L |
分析 燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,a是负极、b是正极,则a极上通入CO、b极通入空气,电解质溶液呈碱性,负极反应式为CO+4OH--2e-=CO32-+2H2O,正极反应式为O2+4e-+2H2O=4OH-;电解精炼粗铜时,根据转移电子相等进行计算.
解答 解:A.电子从a电极流出,则a电极是负极,因此a电极发生氧化反应,b电极发生还原反应,故A错误;
B.a电极通入的是CO,电极反应式为:CO+4OH--2e-=CO32-+2H2O,故B错误;
C.A处通入的是CO,B处通入的是空气,故C错误;
D.用这种电池作电源精炼铜,若阴极质量增加6.4 g,即析出铜的质量是6.4g,物质的量是0.1mol,转移0.2mol电子,则根据方程式CO+4OH--2e-=CO32-+2H2O可知至少消耗标准状况下的CO 2.24 L,故D正确;
故选D.
点评 本题考查原电池原理,明确电子流向与正负极的关系是解本题关键,再结合转移电子守恒、反应类型等知识点分析解答,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,易错选项是B.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
14.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: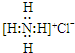 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氟化钠的电子式: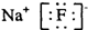 | |
| D. | 氯原子的结构示意图: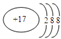 |
15.下列制备实验不可能成功的是( )
| A. | 将冰醋酸、乙醇和浓硫酸混合共热制取乙酸乙酯 | |
| B. | 将乙醇和3mol/L的硫酸按体积比1:3混合共热至170℃制乙烯 | |
| C. | 蔗糖在酸性条件下水解后与新制的氢氧化铜共热能看到红色沉淀 | |
| D. | 用苯、液溴和还原铁粉制溴苯 |
12.下列化合物中,熔沸点最高的是( )
| A. | NaCl | B. | MgCl2 | C. | NaBr | D. | NaI |
4.下列各表述与示意图一致的是(
| A. | 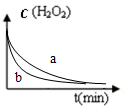 图表示双氧水分解时反应物浓度随时间的变化情况,a为加入少量FeCl3时的变化情况 | |
| B. | 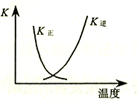 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 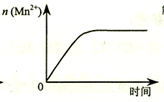 图表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 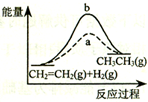 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H>0反应过程中的能量变化,a为不加催化剂时的过程 |
14.已知:H2O(g)=H2O(l)△H=Q1 kJ/mol
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3kJ/mol
若使46克酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3kJ/mol
若使46克酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | ( Q1+Q2+Q3 ) kJ | B. | 0.5( Q1+Q2+Q3 ) kJ | ||
| C. | ( 0.5Q1-1.5Q2+0.5Q3 ) kJ | D. | ( 3Q1-Q2+Q3 ) kJ |
18.根据下列某些短周期元素的性质回答问题.
(1)元素①、②和⑧的第一电离能由大到小的顺序是H>Li>Na(填元素符号);元素③、⑥和⑨的氢化物中沸点由高到低的顺序是H2O>NH3>PH3(填化学式).
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3_(写化学式).
(3)某元素R的原子半径为1.02×10-10m,它与钠形成Na2R2,其电子式是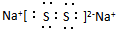 _(R用元素符号表示).
_(R用元素符号表示).
(4)元素①和⑨形成阳离子,其结构式为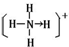 ,含有的化学键类型共价键、配位键.
,含有的化学键类型共价键、配位键.
(5)元素②和⑦形成晶体的部分结构可用下图中的A_来表示(填序号).
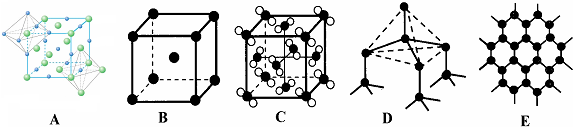
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径/10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
| 最低价态 | -1 | -2 | -4 | -3 | -1 | -3 | -1 |
(2)元素⑤、⑥和⑦的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有CCl4、PCl3_(写化学式).
(3)某元素R的原子半径为1.02×10-10m,它与钠形成Na2R2,其电子式是
 _(R用元素符号表示).
_(R用元素符号表示).(4)元素①和⑨形成阳离子,其结构式为
 ,含有的化学键类型共价键、配位键.
,含有的化学键类型共价键、配位键.(5)元素②和⑦形成晶体的部分结构可用下图中的A_来表示(填序号).

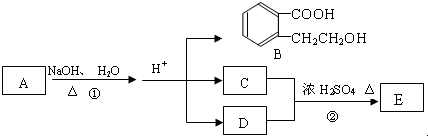
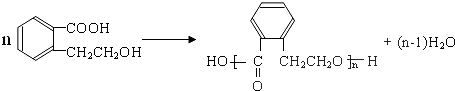 .(不用写条件)
.(不用写条件)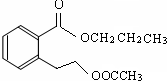 .
.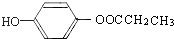 .
.