20. 某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
请按要求填空:
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下,请将表格中实验1的现象补充:
有同学认为实验II的结论合理,请说明理由实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡;
②若要利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱,则丙中所盛装的试剂为NaBr溶液,能得到结论的实验现象为试管中溶液由无色变为橙色;
③某同学用该装置探究氯气与KI的反应,在丙中盛放有KI淀粉溶液,通入氯气,看到丙中溶液变成蓝色,继续通氯气,发现蓝色逐渐消失,检测到溶液中有含+5价元素的酸根离子,则蓝色消失过量中丙中发生反应的化学方程式是5Cl2+I2+6H2O=2HIO3+10HCl.
(2)B、D、E装置相连后,在B中盛装铜片(放在有孔塑料板上)和浓硝酸,关闭c,打开a、b,即可在试管丁中收集到NO2.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②欲用D装置验证NO2与水的反应,在试管中收集满NO2后,使烧杯中的水进入试管丁的操作是(不可改变试管和烧杯的位置):先关闭止水夹 ab,再打开止水夹 c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.
 某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).请按要求填空:
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下,请将表格中实验1的现象补充:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有 较强的酸性 |
②若要利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱,则丙中所盛装的试剂为NaBr溶液,能得到结论的实验现象为试管中溶液由无色变为橙色;
③某同学用该装置探究氯气与KI的反应,在丙中盛放有KI淀粉溶液,通入氯气,看到丙中溶液变成蓝色,继续通氯气,发现蓝色逐渐消失,检测到溶液中有含+5价元素的酸根离子,则蓝色消失过量中丙中发生反应的化学方程式是5Cl2+I2+6H2O=2HIO3+10HCl.
(2)B、D、E装置相连后,在B中盛装铜片(放在有孔塑料板上)和浓硝酸,关闭c,打开a、b,即可在试管丁中收集到NO2.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②欲用D装置验证NO2与水的反应,在试管中收集满NO2后,使烧杯中的水进入试管丁的操作是(不可改变试管和烧杯的位置):先关闭止水夹 ab,再打开止水夹 c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.
19.有5种有机物:①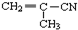 ②
②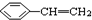 ③
③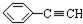 ④CH3-CH=CH-CN ⑤CH2=CH-CH=CH2,其中可用于合成高分子材料(结构如图所示)的正确组合为( )
④CH3-CH=CH-CN ⑤CH2=CH-CH=CH2,其中可用于合成高分子材料(结构如图所示)的正确组合为( )
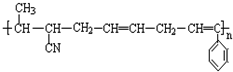
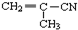 ②
②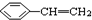 ③
③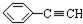 ④CH3-CH=CH-CN ⑤CH2=CH-CH=CH2,其中可用于合成高分子材料(结构如图所示)的正确组合为( )
④CH3-CH=CH-CN ⑤CH2=CH-CH=CH2,其中可用于合成高分子材料(结构如图所示)的正确组合为( )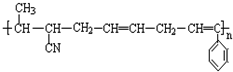
| A. | ①②④ | B. | ①②⑤ | C. | ②④⑤ | D. | ③④⑤ |
18.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83g X的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀.由此可推断出X的化学式为( )
| A. | K2SO4•2Cr2(SO4)3 | B. | 2K2SO4•Cr2(SO4)3 | C. | K2SO4•Cr2(SO4)3 | D. | K2SO4•$\frac{1}{2}$Cr2(SO4)3 |
17.下列变化过程需要吸收能量的是( )
| A. | 氢气球发生爆炸 | B. | 向污染的河水中投放生石灰 | ||
| C. | 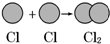 | D. | 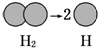 |
16.既能用来鉴别甲烷与乙烯,又能用来除去甲烷中的乙烯以提纯甲烷的方法是( )
| A. | 通过足量的NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的酸性KMnO4溶液 |
15.下列变化涉及的反应类型中,属于加成反应的是( )
| A. | 苯→环已烷 | B. | 乙烯→聚乙烯 | C. | 苯→溴苯 | D. | 甲烷→四氯甲烷 |
14.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2的电子式: | B. | Cl-的结构示意图: | ||
| C. | 乙醇的结构式:CH3CH2OH | D. | 乙烯的结构简式:CH2CH2 |
13.铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电过程中,正极附近溶液的pH增大 | |
| C. | 电池放电时,电解质溶液中OH-移向正极 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
11.(1)请完成该反应的离子方程式:
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为0.13mol/(L•min).(精确到0.01)
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
①当压强从2×105 Pa增加到5×105Pa时,平衡不移动(填:向左,向右,不)
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
0 169186 169194 169200 169204 169210 169212 169216 169222 169224 169230 169236 169240 169242 169246 169252 169254 169260 169264 169266 169270 169272 169276 169278 169280 169281 169282 169284 169285 169286 169288 169290 169294 169296 169300 169302 169306 169312 169314 169320 169324 169326 169330 169336 169342 169344 169350 169354 169356 169362 169366 169372 169380 203614
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)