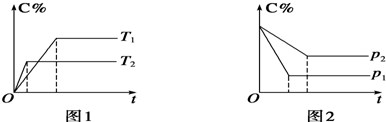题目内容
18.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83g X的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀.由此可推断出X的化学式为( )| A. | K2SO4•2Cr2(SO4)3 | B. | 2K2SO4•Cr2(SO4)3 | C. | K2SO4•Cr2(SO4)3 | D. | K2SO4•$\frac{1}{2}$Cr2(SO4)3 |
分析 3.81gI2的物质的量为0.015mol,根据电子转移守恒计算Cr2O72-的物质的量,根据Cr元素守恒可知n(Cr3+)=2n(Cr2O72-);溶液中加入过量的BaCl2溶液,得到4.66g白色沉淀为硫酸钡,硫酸钡的物质的量为0.02mol,根据硫酸根守恒可知,溶液中n(SO42-)=0.02mol;溶液为电中性,所以n(K+)+3n(Cr3+)=2n(SO42-),计算n(K+),根据K+、Cr3+、SO42-的物质的量之比判断X的化学式.
解答 解:3.81gI2的物质的量为:$\frac{3.81g}{254g/mol}$=0.015mol,根据电子转移守恒可知:n(Cr2O72-)×2×(6-3)=0.015mol×2,解得:n(Cr2O72-)=0.005mol,根据Cr元素守恒可知:n(Cr3+)=2n(Cr2O72-)=0.005mol×2=0.01mol;
溶液中加入过量的BaCl2溶液,得到4.66g白色沉淀为硫酸钡,硫酸钡的物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,根据硫酸根守恒可知,溶液中n(SO42-)=0.02mol;
根据溶液为电中性可得:n(K+)+3n(Cr3+)=2n(SO42-),则:n(K+)=2n(SO42-)-3n(Cr3+)=0.02mol×2-0.01mol×3=0.01mol,
故化合物X中K+、Cr3+、SO42-的物质的量之比为:0.01mol:0.01mol:0.02mol=1:1:2,
所以化合物X的化学式为:K2SO4•Cr2(SO4)3,
故选C.
点评 本题考查了复杂化学式的计算,题目难度中等,注意质量守恒定律、电荷守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. |  | B. |  | C. |  | D. |  |

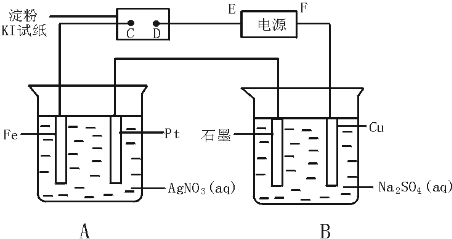
(1)图1是锌锰干电池基本构造图,该电池的负极材料是Zn;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑;当电路中每通过0.2mole-,负极质量减少6.5g;
(2)图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣MnO2的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有烧杯和玻璃棒;
(3)图3是探究MnO2在制O2过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表(已知:两次实验气体的体积在相同条件下测定:H2O2由分液漏斗滴入到圆底烧瓶).
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
| 实验一 | 足量MnO2 | a.充分反应后未见黑色固体物质减少 b.收集到112mL气体 | ①催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | c.充分反应后黑色粉末部分溶解 d.收集到112mL气体 | ②氧化剂 |
④实验一、二中参加反应的H2O2的物质的量之比为2:1.
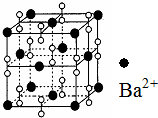 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电过程中,正极附近溶液的pH增大 | |
| C. | 电池放电时,电解质溶液中OH-移向正极 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| A. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)═c(H+)+c(HS-)+c (H2S) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合:c(HCN)+c(CN-)═2 c(Na+) |
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)配制成250mL溶液使用的量具是250mL容量瓶,指示剂还可用甲基橙;
(3)滴定终点的现象是浅红色溶液变为无色,30秒内不褪色.
(4)滤液中溶质的物质的量浓度为0.1250 mol L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)