13.下表中对离子方程式的评价不合理的是
( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通往少量的SO2: ClO-+H2O+SO2=Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入少量NaOH溶液 NH4++OH-=NH3•H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | 正确 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
11.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.下列做法不符合绿色化学理念的是( )
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 用反应:2CH2=CH2+O2$\stackrel{Ag}{→}$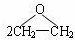 制备环氧乙烷 制备环氧乙烷 |
10.下列有关化学用语错误的是( )
| A. | N原子价层轨道表示式: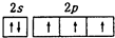 | |
| B. | H2O电子式为 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)原子的原子结构示意图为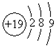 |
7.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
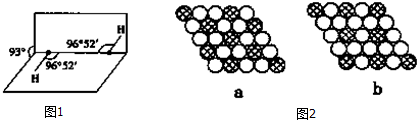
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.
(6)H2S和H2O2的主要物理性质如表所示:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大.
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.

(6)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
4.向盛有紫色石蕊试液的试管中加入过量的Na2O2粉末,充分振荡后,不能观察到的现象是( )
0 169086 169094 169100 169104 169110 169112 169116 169122 169124 169130 169136 169140 169142 169146 169152 169154 169160 169164 169166 169170 169172 169176 169178 169180 169181 169182 169184 169185 169186 169188 169190 169194 169196 169200 169202 169206 169212 169214 169220 169224 169226 169230 169236 169242 169244 169250 169254 169256 169262 169266 169272 169280 203614
| A. | 试管外壁发热 | B. | 溶液最后变为蓝色 | ||
| C. | 溶液先变蓝最后褪色 | D. | 有气泡冒出 |
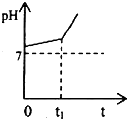 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题: