题目内容
7.物质结构决定性质,深入研究物质的微观结构,有利于理解物质变化的本质.请回答下列问题:(1)C、Si、N的电负性由大到小的顺序是N>C>Si;Na、Mg、Al的第一电离能由大到小的顺序是Mg>Al>Na.
(2)A、B均为短周期金属元素.依据表中的数据,写出B原子的电子排布式:1s22s22p63s2.
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,L是Cl(填元素符号).
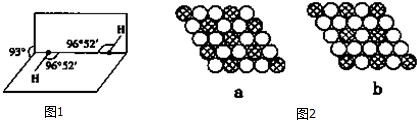
(5)如图1所示是H2O2的空间构型,H2O2分子中每个氧原子都是杂化,H2O2为极性 (填“极性”或“非极性”)分子.
(6)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(7)如图2所示为二维平面晶体示意图,所表示的化学式为AX3的是b.
分析 (1)同周期随原子序数增大,电负性增大,同主族自上而下电负性减小;
同周期随原子序数增大,第一电离能呈增大趋势,Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(3)根据核外电子排布规律,书写Mn2+的核外电子排布式,据此结合题目信息“d轨道为d0或d10排布时,无颜色,为d1~d9排布时,有颜色”判断;
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,核外电子排布式为1s22s22p63s23p5;
(5)由H2O2的空间结构,可知H2O2分子中正负电荷重心不重合;
(6)H2O2分子之间存在氢键,与水分子形成氢键;
(7)a、b中每个黑色球周围有6个白色球,a中每个白色球为3个黑色球共有,b中每个白色球为2个黑色球共有,利用均摊法计算黑色球和白色球数目之比确定化学式.
解答 解:(1)同周期随原子序数增大,电负性增大,同主族自上而下电负性减小,故电负性:N>C>Si,
同周期随原子序数增大,第一电离能呈增大趋势,Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能为:Mg>Al>Na,
故答案为:N>C>Si;Mg>Al>Na;
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(3)Mn2+的核外电子排布式为1s22s22p63s23p63d8,d能级未排满电子,故[Mn(H2O6)]2+ 有颜色,故答案为:有;
(4)L的原子核外电子占有9个轨道,而且有一个未成对电子,核外电子排布式为1s22s22p63s23p5,故L为Cl元素,故答案为:Cl;
(5)由H2O2的空间结构,可知H2O2分子中正负电荷重心不重合,属于极性分子,
故答案为:极性;
(6)O元素非金属性较强,H2O2分子之间存在氢键,沸点高于硫化氢,H2O2分子与水分子形成氢键,硫化氢和水分子间不能形成氢键,H2O2的在水中溶解度远远大于H2S,
故答案为:H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大;
(7)a图中每个黑色球周围有6个白色球,而每个白色球为3个黑色球共有,故黑色球与白色球数目之比=1:6×$\frac{1}{3}$=1:2,表示的化学式为AX2,
b图中每个黑色球周围有6个白色球,而每个白色球为2个黑色球共有,故斜线球与白色球数目之比=1:6×$\frac{1}{2}$=1:3,表示化学式为AX3,
故答案为:b.
点评 本题是对物质结构的考查,涉及电负性、电离能、核外电子排布、配合物、分子极性、氢键、晶胞计算等,属于拼合型题目,注意理解电离能与化合价的关系、同周期第一电离能异常情况.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
| A. | 硫酸钠溶液和氯化钡溶液 | B. | 硝酸钠溶液与氯化钾溶液 | ||
| C. | 稀盐酸和碳酸钠溶液 | D. | 稀硫酸滴到铜片上 |
| A. | ①②③ | B. | ②④⑤ | C. | 仅①③ | D. | ①②③④⑤ |
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |
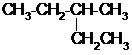 的系统命名为2-甲基戊烷;.
的系统命名为2-甲基戊烷;. ③白磷 ④18O ⑤
③白磷 ④18O ⑤