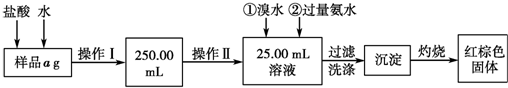
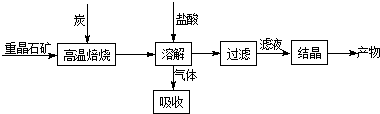
题目内容
6.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g•mol-1.若阿伏加德罗常数用NA表示,则:(1)该气体的物质的量为mMmM;
(2)该气体所含原子总数为2mNAM2mNAM个;
(3)该气体在标准状况下的体积为22.4mM22.4mM;
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为100mm+1000100mm+1000%.
分析 (1)据n=mMmM计算;
(2)根据每个分子中含有的原子数计算总原子数;
(3)根据V=nVm计算;
(4)计算溶液和溶质的质量,可计算质量分数.
解答 解:(1)m g某气体的物质的量为mgMg/molmgMg/mol=mMmM mol,
故答案为:mMmM;
(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2×mMmM mol×NAmol-1=2mNAM2mNAM,
故答案为:2mNAM2mNAM;
(3)该体积的体积为mMmM mol×22.4L/mol=22.4mM22.4mML,
故答案为:22.4mM22.4mM;
(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω=mm+1000mm+1000×100%=100mm+1000100mm+1000%,
故答案为:100mm+1000100mm+1000%.
点评 本题考查了有关物质的量的简单计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量等物理量之间的转化关系.

练习册系列答案
相关题目
17.下列叙述不正确的是( )
| A. | 焊锡(锡铅合金)熔点比金属锡高 | |
| B. | 生成物的能量与反应物的能量一般都不相等 | |
| C. | 使用催化剂,可加快反应速率,但不能改变反应限度 | |
| D. | 用CaSO4可降低盐碱地(含Na2CO3、NaCl)土壤的碱性 |
11.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染.下列做法不符合绿色化学理念的是( )
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)△_△–––––– CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 用反应:2CH2=CH2+O2Ag→Ag→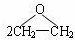 制备环氧乙烷 制备环氧乙烷 |
18.下列有关化学用语表示正确的是( )
| A. | CO2分子比例模型: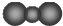 | B. | 硫离子的结构示意图为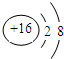 | ||
| C. | NH4Cl的电子式为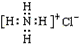 | D. | 中子数为20的氯原子37173717Cl |
15.下列物质中,只含有离子键的是( )
| A. | NaOH | B. | H2 | C. | NaCl | D. | H2S |
16.下列反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫NH3•H2O+SO2═NH4++HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+═Fe(OH)3↓+3 NH4+ |

 、
、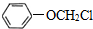 (写两种)
(写两种)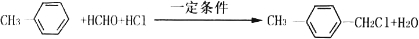 ,
,