题目内容
4.向盛有紫色石蕊试液的试管中加入过量的Na2O2粉末,充分振荡后,不能观察到的现象是( )| A. | 试管外壁发热 | B. | 溶液最后变为蓝色 | ||
| C. | 溶液先变蓝最后褪色 | D. | 有气泡冒出 |
分析 向紫色石蕊试液中加入过量的Na2O2粉末,过氧化钠先与水反应生成氢氧化钠和氧气,成碱性使溶液变为蓝色,后过量的Na2O2粉末又具有强氧化性漂白,以此解答.
解答 解:向紫色石蕊试液中加入过量的Na2O2粉末,过氧化钠先与水反应生成氢氧化钠和氧气,成碱性使溶液变为蓝色,后过量的Na2O2粉末又具有强氧化性漂白,所以看到的现象为,试管外壁发热,溶液先变为蓝色后褪色,并有气泡产生,故B错误.
故选B.
点评 本题考查过氧化钠的性质,为高频考点,把握物质的性质及用途、反应与现象的关系、反应原理的应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列化学用语中,书写或说法正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 丙烷的球棍模型为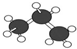 | |
| C. | 乙醇含有的官能团是-OH,带一个单位负电荷 | |
| D. | 乙酸的分子式:C2H4O |
14.下列化学实验的处理及现象不正确的是( )
| A. | 鉴别溶液中是否含有SO42- 时,先滴入稀盐酸使溶液酸化,再滴入氯化钡溶液 | |
| B. | 实验室用H2O2分解制O2,加入少量MnO2后,反应速率明显加快 | |
| C. | 为了加快制取NO气体的速度,可用浓硝酸代替稀硝酸与铜反应 | |
| D. | 检验溶液中是否含有NH4+,可加入足量NaOH溶液,加热,再用湿润的红色石蕊试纸伸入试管内检验是否变蓝 |
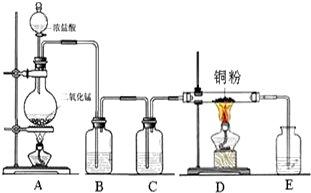 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: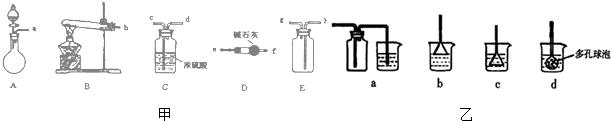
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题: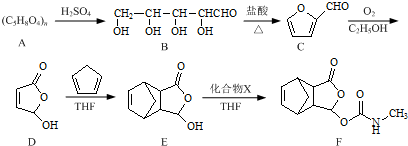
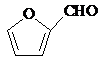 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$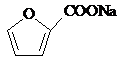 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.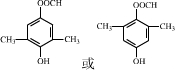 .
.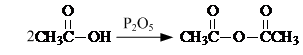 .
.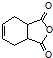 是合成抗病毒药阿昔洛韦的中间体,它可以用
是合成抗病毒药阿昔洛韦的中间体,它可以用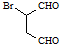 经氧化、消去、成酐一系列反应后再和原料M合成.
经氧化、消去、成酐一系列反应后再和原料M合成.