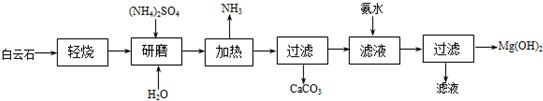
17. 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4.以下说法错误的是( )
 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
16.下列说法错误的是( )
| A. | 利用以下实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验 | |
| B. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| C. | 向两支盛有KI3溶液的试管中分别加入淀粉和硝酸银溶液,前者溶液变蓝后者产生黄色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科学家在研究物质微观结构的过程中先后使用了光学显微镜、电子显微镜、扫描隧道显微镜等观测仪器 |
15.背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价)
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种使水快速分解成氧气的分子催化剂.
下列说法不正确的是( )
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价)
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种使水快速分解成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 雾霾中含有大量的PM2.5,PM2.5又称为“细颗粒物”,它容易附着有毒有害物质,尤其是重金属,对人体造成危害 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
13.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2 4NO+6H2O.
4NO+6H2O.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2
 4NO+6H2O.
4NO+6H2O.
12.下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)10种元素中,化学性质最不活泼的是Ar;
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式 .
.
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式
 .
.(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
11.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量筒、250mL容量瓶、胶头滴管;
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.
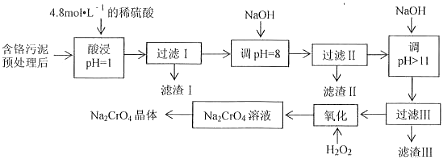
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.

10.硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取MgSO4•7H2O的工艺流程如下:
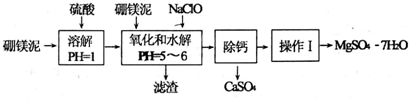
已知:NaClO与Mn2+反应产生MnO2沉淀.
(1)实验中需用1.00mol•L-1的硫酸80.0ml.若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
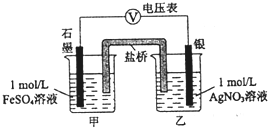
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

9.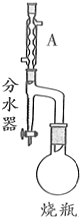 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
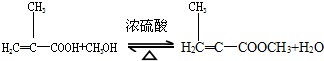
实验步骤:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g•cm-3) |
| 甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
| 甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
| 甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
8.某小组利用如图装置,用苯与溴在FeBr3催化作用下制备溴苯:
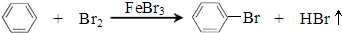
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:
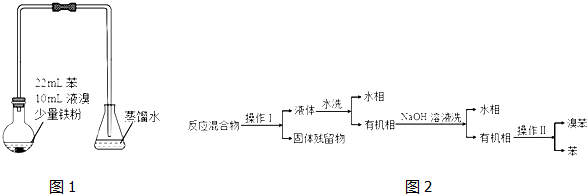
已知:
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
0 168938 168946 168952 168956 168962 168964 168968 168974 168976 168982 168988 168992 168994 168998 169004 169006 169012 169016 169018 169022 169024 169028 169030 169032 169033 169034 169036 169037 169038 169040 169042 169046 169048 169052 169054 169058 169064 169066 169072 169076 169078 169082 169088 169094 169096 169102 169106 169108 169114 169118 169124 169132 203614
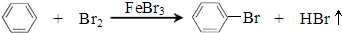
反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:

已知:
| 沸点℃ | 密度g/cm3 | 溶解性 | |
| 溴 | 59 | 3.119 | 水中溶解度小,易溶于有机溶剂 |
| 苯 | 80 | 0.8765 | 难溶于水,与有机溶剂互溶 |
| 溴苯 | 156 | 1.50 | 难溶于水,与有机溶剂互溶 |
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | 将锥形瓶中液体转入分液漏斗,加入适量四氯化碳,振荡后分液.分别取少量上层无色溶液于试管A、B中 | ||
| 2 | 锥形瓶中液体含大量 Br- | ||
| 3 | 锥形瓶中液体含大量 H+ |