题目内容
14.氢氧化镁广泛用作阻燃剂和填充剂.以白云石(化学式:MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如下: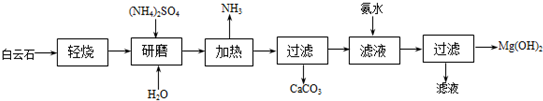
(1)根据流程图,白云石“轻烧”分解的化学反应式是MgCO3=△=MgO+CO2↑.
(2)“研磨”的目的是增大反应物之间的接触面积,反应速度快且充分.
(3)加入氨水时反应的化学方程式为MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4;检验Mg(OH)2沉淀是否洗涤干净的方法是取少量最后一次洗涤液,加盐酸酸化,再加入氯化钡溶液,若无沉淀生成,说明已洗净.
(4)本流程中可以循环利用的物质是(NH4)2SO4、NH3.
(5)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是减少能源消耗,便于分离出CaCO3.
分析 流程分析白云石主要成分为MgCO3•CaCO3轻烧,从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体,
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁;
(2)“研磨”可以增大反应物之间的接触面积,反应速度快且充分;
(3)加入氨水,生成氢氧化镁沉淀;检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子,洗涤Mg(OH)2沉淀所用玻璃仪器有漏斗、烧杯、玻棒等,取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
(4)分析流程可知,(NH4)2SO4 、NH3可以循环利用;
(5)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离.
解答 解:(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,分解生成氧化镁,方程式为MgCO3=△=MgO+CO2↑;
故答案为:MgCO3=△=MgO+CO2↑;
(2)“研磨”可以增大反应物之间的接触面积,反应速度快且充分;
故答案为:增大反应物之间的接触面积,反应速度快且充分;
(3)加入氨水,生成氢氧化镁沉淀,方程式为MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4;检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子,洗涤Mg(OH)2沉淀所用玻璃仪器有漏斗、烧杯、玻棒等,取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
故答案为:MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4;取少量最后一次洗涤液,加盐酸酸化,再加入氯化钡溶液,若无沉淀生成,说明已洗净;
(4)由流程图可知,(NH4)2SO4 、NH3可以循环利用;
故答案为:(NH4)2SO4 、NH3;
(5)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离;
故答案为:减少能源消耗或便于CaCO3分离;
故答案为:减少能源消耗,便于分离出CaCO3 或减少CO2的排放.
点评 本题考查了物质分离方法和流程理解应用,主要是混合物分离试剂的作用,产物的分析判断,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
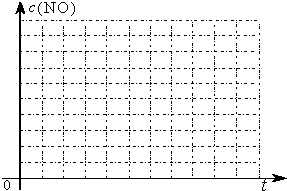
小学生10分钟应用题系列答案为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•S-1.
(2)在该温度下,反应的平衡常数K=5000 L•mol-1.
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.
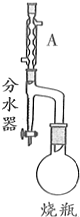 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g•cm-3) |
| 甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
| 甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
| 甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球与蒸馏烧瓶支管口在同一高度处 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后,还需加少量蒸馏水再趁热过滤 | |
| D. | 除去混在苯中的苯酚时,可先加入饱和浓溴水,振荡后静置,再过滤 |
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同族元素中Z的氢化物沸点最低 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
| A. | Na+、K+、SO42-、Br- | B. | Fe3+、Mg2+、HCO3-、Cl- | ||
| C. | H+、K+、I-、ClO- | D. | Ag+、NH4+、NO3-、Cl- |
 ;
; ;
;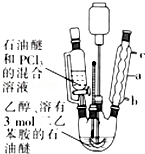 亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl
亚磷酸三乙酯[P(OC2H5)3]常用作塑料稳定剂、增塑剂,也用作医药、农药的中间体.其合成原理为PCl3+3C2H5OH$\stackrel{△}{→}$P(OC2H5)3+3HCl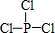 .
.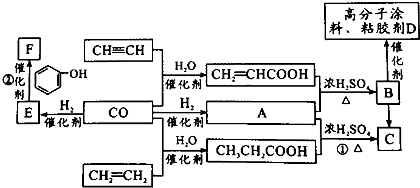
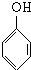 +nHCHO$\stackrel{催化剂}{→}$
+nHCHO$\stackrel{催化剂}{→}$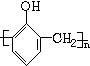 +nH2O.
+nH2O.