题目内容
12.下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式
 .
.(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
分析 根据元素周期表的结构得出,表中所示元素分别是:①Na ②K ③Mg ④Ca ⑤Al ⑥C ⑦S ⑧O ⑨Br ⑩Ar,
(1)原子结构越稳定,化学性质越不活泼;
(2)判断金属性强弱依据:金属性越强,最高价氧化物的水化物的碱性越强;
(3)电子层结构相同的粒子,核电荷数越大,微粒半径越小;
(4)活泼金属与活泼非金属易形成离子化合物;
(5)氢氧化铝是两性氢氧化物,既能与酸反应,又可与碱反应;
(6)常温下,沸点:液态>气态;
(7)可依据“非金属性较强的可置换非金属性较弱的元素的单质”设计实验.
解答 解:根据元素周期表的结构得出,表中所示元素分别是:①Na ②K ③Mg ④Ca ⑤Al ⑥C ⑦S ⑧O ⑨Br ⑩Ar
(1)稀有气体元素原子最外层电子数为8(K层是2)时,原子结构很稳定,化学性质不活泼,它们位于元素后期表的0族.所以10种元素中,化学性质最不活泼的是表中所示位于第三周期的⑩,是Ar,故答案为:Ar;
(2)根据周期表中元素性质的递变规律,位于元素周期表的“左下”元素金属性更强,所以④②⑤中金属性最强的是②钾元素,其对应的最高价氧化物的水化物是KOH,金属性越强,其对应的最高价氧化物的水化物的碱性越强.故答案为:KOH;
(3)②④⑦对应的简单离子分别是:K+、Ca2+、S2-,它们的电子层结构相同(电子层数一样,各层上的电子数一样),核电荷数越大,半径越小.所以半径由大到小的顺序是;S2->K+>Ca2+,故答案为:S2->K+>Ca2+;
(4)①、⑦分别是钠、硫,二者形成的最简单化合物的是离子化合物Na2S;对应电子式为: ,故答案为:
,故答案为: ;
;
5)①和⑤分别是钠与铝,对应的最高价氧化物对应的水化物分别是NaOH、Al(OH)3 ,二者反应方程式为:NaOH+Al(OH)3=Na[Al(OH)4],
故答案为:NaOH+Al(OH)3=Na[Al(OH)4];
(6)⑦与⑧分别是O、S,两种元素最简单氢化物分别是:H2O>H2S;常温下,H2O是液态,H2S是气态,所以沸点H2O>H2S,故答案为:H2O>H2S;
(7)⑦⑨两种元素分别是硫、溴,判断非金属性强弱的依据之一是单质之间的置换反应(强可制弱),
故答案为:把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
点评 元素的性质与原子结构之间的关系,有很强的规律性,要多练多总结,熟练应用,是高考常考点.

| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: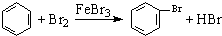 |
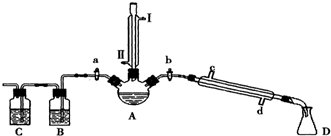
请根据实验步骤,回答下列问题:
(1)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.
竖直冷凝管接通冷凝水,进水口是Ⅱ(填“I”或“Ⅱ”);竖直冷凝管的主要作用是冷凝回流.
(2)理论上,上述反应的副产物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氢、硫酸氢钠、水等.熄灭酒精灯,在竖直冷凝管上方塞上塞子并打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物,已知B、C装置中为常见物质的水溶液.
B装置检验的物质是溴化氢,写出C装置中主要的化学方程式:CH3CH2CH=CH2+Br2→BrCH2CHBrCH2CH3.
(3)为了进一步分离提纯1-溴丁烷,该兴趣小组同学查得相关有机物的数据如表所示:
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
①待烧瓶冷却后,拔去竖直的冷凝管;
②插上带橡皮塞的温度计;
③关闭a,打开b;
④接通冷凝管的冷凝水,使冷水从d处流入;
⑤迅速升高温度至101.6℃,收集所得馏分.
(4)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g1-溴丁烷,则1-溴丁烷的产率是0.70.(答案用小数表示,保留2位小数)
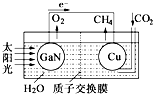 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
| A. | 标况下,1.12LHCHO含有的电子数为1.5NA | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA | |
| D. | 1.0L 0.1 mol•L-1的FeCl3溶液中含有Fe3+数目为0.1NA |
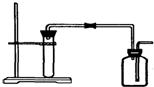
| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |
| A. | 滴入酚酞试液显红色的溶液中:K+、Na+、Cu2+、SO42- | |
| B. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Ba2+、Cl-、ClO- | |
| C. | 水电离产生的c(H+)=10-13mol•L-1 的溶液中:Na+、Cl-、NO3-、CH3COO- | |
| D. | pH=0的溶液中:Na+、NO3-、S2-、Cl- |