13.在密闭容器中进行如下可逆反应:X2(g)+Y2(g)?2XY(g),已知X2、Y2、XY三者起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下反应处于平衡,此时容器中不可能的情况是( )
| A. | XY为0.3mol/L | B. | Y2为0.35mol/L | ||
| C. | X2为0.2mol/L | D. | X2、Y2、XY总浓度为0.6mol/L |
12.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-→2Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
11.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
10.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e+4OH-═AlO2-+2H2O | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,其负极反应式为:Cu-2e-═Cu2+ |
8. 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
7.有下列两组命题
B组命题正确且能用A组命题给以正确解释的是( )
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键能 Ⅱ.H-I键键能小于H-Cl键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | a.HI比HCl稳定 b.HCl比HI稳定 c.HI沸点比HCl高 d.HI沸点比HCl低 |
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
6.下列说法正确的是( )
| A. | 第二周期元素的第一电离能随原子序数递增依次增大 | |
| B. | CH2=CH2分子中共有四个σ键和一个π键 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | 电负性:S>P |
5.下列各组P、Q原子中,彼此的化学性质一定相似的是( )
0 168883 168891 168897 168901 168907 168909 168913 168919 168921 168927 168933 168937 168939 168943 168949 168951 168957 168961 168963 168967 168969 168973 168975 168977 168978 168979 168981 168982 168983 168985 168987 168991 168993 168997 168999 169003 169009 169011 169017 169021 169023 169027 169033 169039 169041 169047 169051 169053 169059 169063 169069 169077 203614
| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
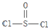 )是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.
)是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.