题目内容
11.运用元素周期律分析下面的推断,其中不正确的是( )| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.At与I同主族,根据同主族的性质的相似性分析;
C.根据同主族元素的性质的相似性和递变性分析;
D.Se与S同主族,根据硫化氢的性质分析.
解答 解:A.非金属性:Cl>Br,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则HClO4的酸性比HBrO4的酸性强,故A错误;
B.卤族元素的单质从上到下颜色逐渐加深,则砹(At)为有色固体,卤族元素单质的卤化银都不溶于水也不溶于硝酸,故B正确;
C.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故C正确;
D.同主族从上到下非金属氢化物的稳定性逐渐减弱,Se与S同主族,则H2Se的稳定性小于H2S,H2Se与H2S均为有毒气体,故D正确.
故选A.
点评 本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
1.元素A的单质及A与B形成的化合物能按如图所示的关系发生转化.则下列说法正确的是( )
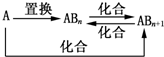

| A. | 图中物质间的转化都不是氧化还原反应 | |
| B. | 当n=1时,A可能是N2 | |
| C. | A一定是金属元素 | |
| D. | 当n=2时,A可能是Fe |
2.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |
19.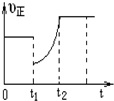 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
6.下列说法正确的是( )
| A. | 第二周期元素的第一电离能随原子序数递增依次增大 | |
| B. | CH2=CH2分子中共有四个σ键和一个π键 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | 电负性:S>P |
16.下列各组离子,一定能在指定环境中大量共存的是( )
| A. | pH=0的溶液中:K+、ClO-、CH3CHO、SO42- | |
| B. | c(H+)=10-12mol•L-1的溶液中:Na+、NH4+、Cl-、Br- | |
| C. | 加人KSCN显血红色的溶液中:Br-、NO3-、SO42-、Mg2+ | |
| D. | 在加入Al能放出大量H2的溶液中:NH4+、SO42-、C1-、HCO3- |
1.常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A. | 同温度同物质的量浓度时,HF比HCN酸性强,则同浓度的NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.1mol•L-1的NH4Cl溶液与0.1mol•L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)=c(Na+)>c(NH4+ )>c(OH-)>c(H+) | |
| C. | 相同物质的量浓度的下列溶液中,①NH4Al(SO2)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;其中c(NH${\;}_{4}^{+}$) 由大到小的顺序是:①>②>③>④ | |
| D. | PH=11的Na2CO3溶液中:c(Na+)-2c(CO${\;}_{3}^{2-}$)-c(HCO${\;}_{3}^{-}$)=10-3-10-11 |
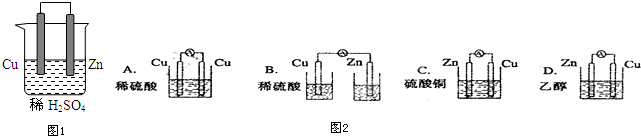
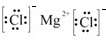



 .
.