题目内容
5.下列各组P、Q原子中,彼此的化学性质一定相似的是( )| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
分析 A.P为He,Q为Be;
B.原子核外M层上仅有两个电子的P为Mg元素,原子核外N层上仅有两个电子有多种元素;
C.2p能级上有1个未成对电子,则P为B或F,3p能级上有1个未成对电子,则Q为Al或Cl;
D.2p轨道上只有一个空轨道的P原子是C,3p轨道上只有一个空轨道的Q原子是Si,最外层电子数相同,化学性质相似.
解答 解:A.P为He,属于稀有气体元素性质稳定,Q为Be属于金属元素,易失电子,二者性质不同,故A错误;
B.原子核外M层上仅有两个电子的P为Mg元素,原子核外N层上仅有两个电子的Q可能为Ca、Sc、Ti、V、Fe、Co、Ni、Zn等元素,价电子数不同,性质不相同,故B错误;
C.2p能级上有1个未成对电子,则P为B或F,3p能级上有1个未成对电子,则Q为Al或Cl,所以P、Q的价电子数不一定相同,性质可能不同,故C错误;
D.最外电子层L层上只有一个空轨道,即2p轨道上只有一个空轨道的P原子是C,3p轨道上只有一个空轨道的Q原子是Si,最外层电子数都为4,化学性质相似,故D正确;
故选D.
点评 本题考查原子的结构和元素的性质,题目难度不大,注意原子核外电子排布特点与对应元素化合物的性质的关系.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在 | |
| B. | 用酸性KMnO4溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙稀 | |
| C. | 用溴水鉴别乙烯与乙炔 | |
| D. | CH4和Cl2在光照条件下反应的产物最多可能有四种 |
16.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物与其最高价氧化物的水化物能形成离子化合物,Y与Q同主族;常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Z的最高价氧化物的水化物显两性 | |
| B. | XY3中的X呈+3价 | |
| C. | Y最高价氧化物水化物的酸性比W的强 | |
| D. | Z与Q形成的是离子化合物 |
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
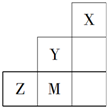

| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
10.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e+4OH-═AlO2-+2H2O | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,其负极反应式为:Cu-2e-═Cu2+ |
17.常温下时,有pH=3的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
14.关于如图所示的原电池,下列说法错误的是( )


| A. | Cu为正极,Zn为负极 | B. | 该装置能将化学能转化为电能 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 正极反应为:2H++2e-═H2↑ |
15.下列说法正确的是( )
| A. | 有一种第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的转化是化学变化 | |
| B. | NO2能与水反应生成硝酸,所以NO2是酸性氧化物 | |
| C. | 铝粉和氧化镁粉末可以组成铝热剂发生铝热反应 | |
| D. | 某元素的气态氢化物能与其最高价氧化物对应的水化物发生化学反应,则该元素一定是N元素 |