题目内容
12.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-→2Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
分析 A.该原电池中,Zn失电子发生氧化反应而作负极,则Ag2O作正极;
B.失电子发生氧化反应、得电子发生还原反应;
C.放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动;
D.根据电池反应式知,反应中消耗水,KOH不参加反应.
解答 解:A.根据电极反应式知,Zn失电子发生氧化反应而作负极,则Ag2O作正极,故A错误;
B.失电子发生氧化反应、得电子发生还原反应,所以锌发生氧化反应、氧化银发生还原反应,故B错误;
C.放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,所以溶液中OH-向负极移动,K+、H+向正极移动,故C错误;
D.根据电池反应式知,反应中消耗水,KOH不参加反应,所以随着反应的进行,溶液中KOH浓度增大,溶液的pH增大,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确正负极与得失电子关系是解本题关键,知道离子移动方向、反应类型,易错选项是D.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
2.2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂.苯丙醇胺(英文缩写为PPA)结构简式如下: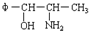 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
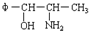 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
3.向2L密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+2N(g)?E(g),当反应进行到4min时,测知M的浓度为0.2mol/L,则化学反应的平均速率( )
| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
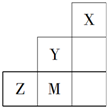

| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
7.有下列两组命题
B组命题正确且能用A组命题给以正确解释的是( )
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键能 Ⅱ.H-I键键能小于H-Cl键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | a.HI比HCl稳定 b.HCl比HI稳定 c.HI沸点比HCl高 d.HI沸点比HCl低 |
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
17.常温下时,有pH=3的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
4.某烃0.1mol,在氧气中完全燃烧,生成13.2g CO2、7.2gH2O,则该烃的分子式为( )
| A. | 乙烯 | B. | 乙烷 | C. | 丙烯 | D. | 丙烷 |
1.碳元素有的三种原子:126126C、136136C、146146C,下列各项对三种原子均不同的是( )
| A. | 元素种类 | B. | 核电荷数 | C. | 电子层数 | D. | 中子数 |
 如表为元素周期表短周期的一部分.回答下列问题:
如表为元素周期表短周期的一部分.回答下列问题: