2.下列说法正确的是( )
| A. | 密闭容器中充入1mol N2和3mol H2可生成2mol NH3 | |
| B. | 改变条件不能改变可逆反应的限度 | |
| C. | 当某反应在一定条件下达到反应限度时即达到了化学平衡状态 | |
| D. | 当某反应达到限度时,反应物和生成物的浓度一定相等 |
1.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染.其电池反应为2Zn+O2═2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )
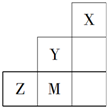

| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
19.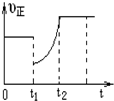 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
18.将4mol A和2mol B放入2L密闭容器中发生反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
| A. | 4 s内,v(B)=0.075 mol/(L•s) | |
| B. | 4 s后平衡状态下,c(A):c(C)=2:1 | |
| C. | 达到平衡状态时,若只升高温度,则C的物质的量浓度增大 | |
| D. | 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低 |
17.在密闭容器中进行反应2SO2+O2?2SO3,SO2、O2、SO3的起始浓度分别为0.2mol•L-1,0.1mol•L-1,0,2mol•L-1,当平衡时,下列数据正确的是( )
| A. | SO2的浓度为0.25 mol•L-1,SO3的浓度为0.25mol•L-1 | |
| B. | SO3的浓度为0.3mol•L-1 | |
| C. | SO2的浓度为0.4 mol•L-1,O2的浓度为0.2 mol•L-1 | |
| D. | SO3的浓度为0.4 mol•L-1 |
16.已知反应A(g)+3B(g)═2C(g)+D(g)在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L•min),则此段时间内以C的浓度变化表示的化学反应速率为( )
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
14.观察下列模型并结合有关信息,判断有关说法不正确的是( )
0 168882 168890 168896 168900 168906 168908 168912 168918 168920 168926 168932 168936 168938 168942 168948 168950 168956 168960 168962 168966 168968 168972 168974 168976 168977 168978 168980 168981 168982 168984 168986 168990 168992 168996 168998 169002 169008 169010 169016 169020 169022 169026 169032 169038 169040 169046 169050 169052 169058 169062 169068 169076 203614
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |

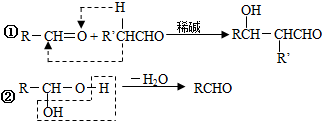
 ;
; ;Ⅱ、D→E2
;Ⅱ、D→E2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;