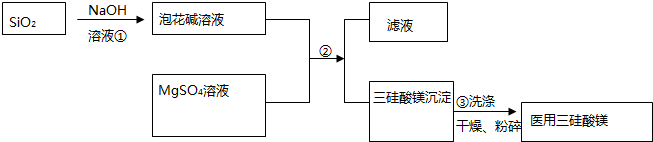
题目内容
3.氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O$\frac{\underline{\;激光\;}}{TiO_{2}}$2H2↑+O2↑.制得的氢气可用于燃料电池.试回答下列问题(1)水分解时,断裂的化学键为共价键(填离子或共价),分解海水的反应属于吸热反应(填放热或吸热).
(2)某种氢氧燃料电池是用固体金属化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-则A极是电池的负极;电子从该极流出(填流入或流出)
(3)有人以化学反应2Zn+O2+4H+═2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作.则原电池的负极材料是Zn,发生的电极反应为Zn-2e-=Zn2+.
分析 (1)水为共价化合物,分解断裂共价键,分解反应需吸收热量;
(2)A极生成水,氢气被氧化,为负极反应,电子从负极经导线流向正极;
(3)由反应2Zn+O2+4H+═2Zn2++2H2O可知,Zn被氧化生成n2+,为负极反应.
解答 解:(1)水为共价化合物,分解时共价键断裂,需吸收热量,故答案为:共价;吸热;
(2)A极生成水,氢气被氧化,为负极反应,电子从负极经导线流向正极,故答案为:负;流出;
(3)由反应2Zn+O2+4H+═2Zn2++2H2O可知,Zn被氧化生成n2+,为负极反应,电极方程式为Zn-2e-=Zn2+,故答案为:Zn;Zn-2e-=Zn2+.
点评 本题考查化学电源新型电池以及原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极反应,题目难度不大,本题注意基础知识的积累.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
14.下列电子式中正确的是( )
①氧原子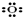 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+
⑤氢离子H+⑥铵根离子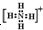 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
①氧原子
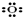 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+⑤氢离子H+⑥铵根离子
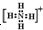 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
| A. | ①②③⑥⑦ | B. | ③④⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ②③④⑦⑧ |
11.下列说法中不正确的是( )
| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
18.将4mol A和2mol B放入2L密闭容器中发生反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
| A. | 4 s内,v(B)=0.075 mol/(L•s) | |
| B. | 4 s后平衡状态下,c(A):c(C)=2:1 | |
| C. | 达到平衡状态时,若只升高温度,则C的物质的量浓度增大 | |
| D. | 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低 |
8. 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
15.如表实验“操作和现象”与“结论”对应关系不相符的是( )
| 选项 | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在试管口观察到红棕色气体 | 发生反应先生成NO,进而与O2反应生成NO2 |
| B | 取皂化反应的混合液滴入盛水的烧杯中,出现油滴 | 皂化反应完全 |
| C | 在溴乙烷中加入NaOH的乙醇溶液并加热,将产生的气体依次通过水、酸性KMnO4溶液,KMnO4溶液紫红色褪色 | 使KMnO4溶液褪色的气体是乙烯 |
| D | 向漂白粉溶液中通入过量的二氧化硫,溶液变浑浊 | 析出了硫酸钙 |
| A. | A | B. | B | C. | C | D. | D |
12.下列物质不是从海水中提取的是( )
| A. | 铝 | B. | 镁 | C. | 液溴 | D. | 重水 |
13.下列各组离子能在指定溶液中,能大量共存的是( )
| A. | 在能使石蕊试纸变蓝色的溶液中:Na+,AlO2-,S2-,SO42- | |
| B. | 由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,CO32-,NH4+,SO32- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4 +、Na+、Fe2+、NO3- | |
| D. | pH=2的溶液中:Na+、SO42-、NO3 -、CO32- |