题目内容
16.已知反应A(g)+3B(g)═2C(g)+D(g)在某段时间内以A的浓度变化表示的化学反应速率为1mol/(L•min),则此段时间内以C的浓度变化表示的化学反应速率为( )| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
分析 根据不同物质表示的反应速率之比等于其化学计量数之比计算v(C).
解答 解:不同物质表示的反应速率之比等于其化学计量数之比,则v(C)=2v(A)=2×1mol/(L•min)=2mol/(L•min),故选C.
点评 本题考查化学反应速率有关计算,比较基础,常用定义法与速率规律进行计算,根据情况选择合适的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.FeS2与硝酸反应产物有Fe3+和H2SO4,若反应中FeS2和HNO3物质的量之比是1:8时,则HNO3的唯一还原产物是( )
| A. | NO2 | B. | NO | C. | N2O | D. | N2O3 |
11.下列说法中不正确的是( )
| A. | 非金属元素之间形成的化合物不一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 在共价化合物中也可能含有离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
1.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染.其电池反应为2Zn+O2═2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是( )
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
8. 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
 某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )
某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未画出),晶体中A、B、C的原子个数之比依次为( )| A. | 1:3:1 | B. | 2:3:1 | C. | 2:2:1 | D. | 1:3:3 |
5.下列各组中,每种电解质溶液电解时电解水类型的是( )
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | NaOH、H2SO4、Ba(OH)2 | D. | NaBr、H2SO4、Ba(OH)2 |
 最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图:
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图: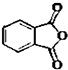 +C4H9OH$\stackrel{H_{2}SO_{4}}{→}$
+C4H9OH$\stackrel{H_{2}SO_{4}}{→}$ 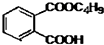 $→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$
$→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$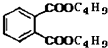
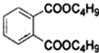 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH. 白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( )
白磷结构如图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有共价键的数目是( ) 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题:
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子.请回答下列问题: