题目内容
20.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法不正确的是( )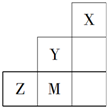
| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
分析 由短周期元素,结合图可知,X为He,Y为F,M为Cl,Z为S.
A、F2和Cl2同为第VIIA族的元素,元素的非金属性越强,单质的氧化性越强;
B、X为He,核外共有2个电子;
C、电子层越多,原子半径越大;同周期从左向右原子半径在减小;
D、元素的非金属性越强,气态氢化物的稳定性越强.
解答 解:由短周期元素,结合图可知,X为He,Y为F,M为Cl,Z为S.
A、F2和Cl2同为第VIIA族的元素,非金属性:F>Cl,而元素的非金属性越强,单质的氧化性越强,故氧化性:F2>Cl2,故A正确;
B、X为He,核外共有2个电子,故X的最外层不是8电子的稳定结构,故B错误;
C、电子层越多,原子半径越大,故原子半径为M>Y;而当电子层数相同时,核电荷数越大,半径越小,故Z>M,则原子半径为Z>M>Y,故C正确;
D、Z和M处于同一周期,同一周期,从左到右,非金属性逐渐增强,而元素的非金属性越强,气态氢化物的稳定性越强,故M的气态氢化物的稳定性强于Z,故D正确.
故选B.
点评 本题考查位置、结构、性质,熟悉元素在短周期的位置及短周期的结构来推断元素是解答本题的关键,选项C为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 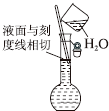 配制溶液 | B. | 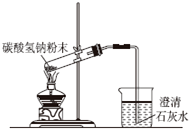 碳酸氢钠受热分解 | ||
| C. | 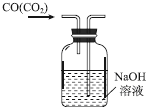 除去CO中的CO2 | D. | 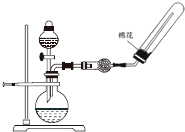 制备收集干燥的氨气 |
11.已知X元素原子的L电子层比Y元素原子的L电子层少2个电子,Y元素原子核外电子总数比X元素核外电子总数多3个,则下列说法不正确的是( )
| A. | X与Y能形成两种化合物,但化学键类型不相同 | |
| B. | Y与氢形成化合物YH,分子内存在离子键 | |
| C. | X与氢可形成化合物H2X2,分子内部存在极性键和非极性键 | |
| D. | Y2X2中阴、阳离子个数比1:2 |
5.下列各组P、Q原子中,彼此的化学性质一定相似的是( )
| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
12.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn+2OH--2e-→Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-→2Ag+2OH-,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.下列说法正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液中KOH的质量分数不断增大 |
9.下列各组物质中,互为同位素的是( )
| A. | T2O与D2O | B. | 4019K与4020Ca | ||
| C. | O2和O3 | D. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C |
10.NA表示阿伏加德罗常数.下列说法中正确的是( )
| A. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA | |
| B. | 6.2gNa2O和7.8gNa2O2混合物中所含有的阴离子数为0.3 NA | |
| C. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023 | |
| D. | 18g D2O(重水)完全电解,转移6.02×1023个电子 |

 ;
; ;Ⅱ、D→E2
;Ⅱ、D→E2 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;