9.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应达到平衡状态时,下列说法正确的是( )
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
8.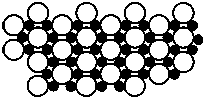 2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )
2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )
 2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )
2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )| A. | MgB | B. | MgB2 | C. | Mg2B | D. | MgB6 |
7.下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
(1)化学性质最不活泼的元素是?Ne(填元素符号).
(2)镁的原子结构示意图为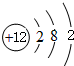 .
.
(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)镁的原子结构示意图为
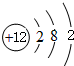 .
.(3)N与O原子半径较大的是N.
(4)H2SO4与HClO4中,酸性较强的是HClO4.
(5)NaOH与Al(OH)3中,属于两性氢氧化物的是,它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(6)Si是良好的半导体材料,它的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料).
(7)碳元素形成的一种氧化物的化学式是?CO或CO2,该物质中C元素与O元素的质量比为3:4或3:8?.(相对原子质量:C-12 O-16)
20.四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍.请用化学用语回答:
(1)丙在元素周期表中的位置第三周期第VIA族
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
0 168855 168863 168869 168873 168879 168881 168885 168891 168893 168899 168905 168909 168911 168915 168921 168923 168929 168933 168935 168939 168941 168945 168947 168949 168950 168951 168953 168954 168955 168957 168959 168963 168965 168969 168971 168975 168981 168983 168989 168993 168995 168999 169005 169011 169013 169019 169023 169025 169031 169035 169041 169049 203614
| 甲 | 乙 | |
| 丙 | 丁 |
(2)乙的两种常见单质分别是O2、O3
(3)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)H2S,HCl
(4)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)H2O2.此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式H2O2+CN-+OH-=CO32-+NH3
(5)实验室制备丁单质的离子方程式4H+(浓)+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(6)若甲的元素符号为X.
已知:①X2(g)+2O2(g)═X2O4(l)△H=-19.5KJ/mol
②X2H4(l)+O2(g)═X2(g)+2H2O(g)△H=-534.2KJ/mol
则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
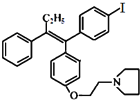 (不考虑立体结构).
(不考虑立体结构).


 D
D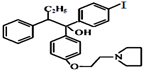
 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种. 中任一种.
中任一种. +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HBr.
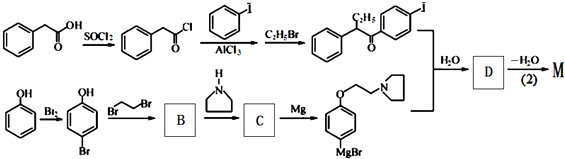
+HBr. 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇 的合成路线
的合成路线 (不超过5步反应).
(不超过5步反应).
 (写结构简式).
(写结构简式). 在一定条件下可水解为
在一定条件下可水解为 和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是
和R1-NH2,则F在强酸和长时间加热条件下发生水解反应的化学方程式是 .
.
 .
.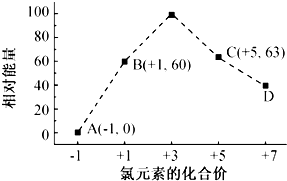
 ,…O-O-O…链状排列中中间氧的价态为0.
,…O-O-O…链状排列中中间氧的价态为0.